Впр экстрофия мочевого пузыря
Содержание статьи
Экстрофия мочевого пузыря

УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Введение
Экстрофия мочевого пузыря (ЭМП) — редкий тяжелый врожденный порок развития нижних мочевых путей, характеризующийся отсутствием передней брюшной стенки и передней стенки мочевого пузыря, а также расхождением лонного сочленения (диастаз). Через дефект передней брюшной стенки пролабирует слизистая оболочка. В нижней части обнаженной слизистой оболочки расположены устья мочеточников, из которых постоянно выделяется моча. Пуповина впадает низко в верхний край дефекта передней брюшной стенки.
Экстрофийные пороки нижних мочевых путей делят на классическую экстрофию мочевого пузыря и экстрофию клоаки. У мальчиков экстрофия мочевого пузыря сочетается с расщеплением мочеиспускательного канала (эписпадия). Экстрофия мочевого пузыря у девочек сопровождается расщеплением клитора, расщеплением или отсутствием мочеиспускательного канала, а также спайками больших и малых половых губ [1, 2].
В литературе экстрофия мочевого пузыря чаще всего описывается в комплексе с эписпадией, хотя имеются сообщения об изолированном поражении стенки мочевого пузыря, когда его шейка и мочеиспускательный канал сформированы. Такая патология называется неполной экстрофией, или переднепузырным свищом. При неполной экстрофии патология половых органов отсутствует [3, 4]. Наиболее тяжелой и редкой формой порока является экстрофия клоаки, при которой расщепление распространяется не только на урогенитальную область, но и на терминальный отдел кишечника [5, 6].
Впервые экстрофию мочевого пузыря, как врожденный порок развития, описал Schenk von Grafenberg в 1597 г. В 1780 г. Chaussier впервые использовал термин «экстрофия». Упоминания об экстрофии мочевого пузыря обнаружены на ассирийских табличках, сделанных 2000 лет до н. э. [7]. Частота экстрофии мочевого пузыря составляет 0,25-0,5 на 10 тыс. новорожденных. Соотношение классической экстрофии мочевого пузыря у мальчиков и девочек 3:1 [1, 8]. При экстрофии мочевого пузыря встречаются сопутствующие врожденные аномалии — паховые грыжи (у 56 % мальчиков, у 15 % девочек), крипторхизм (20 %), колоректальные аномалии (1,8 %) и др. [1, 2]. Экстрофия мочевого пузыря может входить в состав комплекса OEIS (omphalocele, extrophy, imperforate anus, spinal defects), OMIM 258040.
Пренатальная диагностика экстрофии мочевого пузыря возможна уже при первом скрининговом обследовании в 11-14 нед беременности, когда в норме полость мочевого пузыря начинает наполняться мочой. Визуализация мочевого пузыря обязательно входит в стандартные протоколы исследования пренатального скрининга.
Эмбриопатогенез
Экстрофия мочевого пузыря формируется на 4-5-й неделе эмбриогенеза, когда на 28-32-й день происходит каудальная миграция мембраны клоаки. В то же время формируется передняя брюшная стенка, однако если мезенхима не переходит из одного клеточного слоя нижней брюшной стенки в другой, то это приводит к нестабильности клоакальной мембраны. Преждевременный разрыв мембраны клоаки приводит к комплексу «подпупочных» аномалий. Разрыв клоакальной мембраны после полного разделения «урогенитальной» части от пищеварительного тракта приводит к формированию классической экстрофии мочевого пузыря.
Если повреждение мембраны происходит до того, как спускается уроректальная перегородка, тогда это приводит к вывороту нижнего уретрального тракта и части пищеварительного тракта с формированием клоакальной экстрофии. Генетические факторы, связанные с экстрофией мочевого пузыря, на сегодняшний день не выявлены, однако существует гипотеза, что потеря экспрессии р63 из-за полиморфизмов очередности у промотера является фактором риска развития экстрофии мочевого пузыря [1, 9].
Ниже представлен случай диагностики экстрофии мочевого пузыря в III триместре беременности.
Материал и методы
Пациентка С.,18 лет, настоящая беременность первая, от первого брака, супруги соматически здоровы, профессиональных вредностей не имеют, наследственность не отягощена. На учете в женской консультации пациентка состояла с 9 нед беременности. Беременность протекала без осложнений. При скрининговом УЗ-исследовании в I и II триместрах по месту жительства ВПР и УЗ-маркеров хромосомных перестроек у плода не обнаружено.
При УЗ-обследовании в 34 нед беременности в женской консультации по месту жительства было обнаружено образование средней эхогенности размером 28x23x25 мм в области нижних отделов передней брюшной стенки. Женщина была направлена в медикогенетическое отделение МОНИИАГ с диагнозом: «ВПР плода, экстрофия мочевого пузыря?».
УЗ-исследование проводилось на сканере WS80A (компании Samsung Medison) с использованием объемного датчика CV1-8A.
Результаты
При УЗ-исследовании обнаружен один живой плод женского пола в головном предлежании. Гестационный срок составил 34,4 нед. Фетометрические показатели плода соответствовали данному сроку. Патологических изменений плаценты и околоплодных вод не выявлено. При исследовании мочевой пузырь в типичном месте не визуализировался.
В нижних отделах передней брюшной стенки в надлобковой области визуализировалось эхогенное образование размером 30x28x25 мм (рис. 1, 2). Определялось низкое впадение пуповины. Почки плода визуализировались в типичном месте, без структурных изменений. Патологических изменений других органов не было выявлено.

Рис. 1. Эхогенное образование в нижнем отделе передней брюшной стенки (экстрофированный мочевой пузырь).

Рис. 2. Экстрофия мочевого пузыря в сочетании с отсутствием видимой патологии наружных половых органов (режим трехмерной реконструкции).
Поставлен диагноз: «Беременность 34,4 нед. ВПР плода — экстрофия мочевого пузыря».
Обсуждение
Пренатальными УЗ-признаками экстрофии мочевого пузыря являются: отсутствие визуализации мочевого пузыря при нормальном количестве околоплодных вод, структурно неизмененные почки, визуализация эхогенного образования в надлобковой области, аномалии строения половых органов. Использование ЦДК является дополнительным инструментом для диагностики экстрофии мочевого пузыря. В норме пупочные артерии проходят вдоль стенки мочевого пузыря при поперечном сканировании нижней части живота. Для экстрофии мочевого пузыря характерно низкое впадение пуповины, при котором артерии охватывают образование в надлобковой области. При отсутствии визуализации мочевого пузыря в типичном месте необходимо провести повторное сканирование через 30-40 мин для адекватной оценки его расположения и степени наполнения.
Изолированная экстрофия мочевого пузыря, как правило, не сочетается с хромосомными перестройками у плода и не требует пренатального кариотипирования.
В данном клиническом наблюдении экстрофия мочевого пузыря была диагностирована у плода женского пола, что встречается значительно реже, чем у плодов мужского пола. Кроме того, отсутствие выраженной деформации наружных половых органов позволяет предположить неполную форму экстрофии. Оценка анатомии мочевого пузыря включена в протокол обязательного скринингового обследования во всех триместрах беременности. Отсутствие визуализации мочевого пузыря в типичном месте должно насторожить врачей УЗ-диагностики. Однако часто экстрофия мочевого пузыря диагностируют лишь в III триместре беременности.
После рождения детям с экстрофией мочевого пузыря требуется многоэтапная сложная хирургическая коррекция. Процент неудовлетворительных отдаленных результатов, к сожалению, остается на сегодняшний день очень высоким, как правило, вследствие присоединения таких осложнений, как нарушение функции тазовых органов: недержание мочи, рубцовая деформация половых органов, половая дисфункция, выраженная деформация передней брюшной стенки, уретерогидронефроз III-IV степени, непрерывно рецидивирующий пиелонефрит со снижением функции почек, хроническая почечная недостаточность и др. [4, 7]. Огромной и сложной проблемой остается медико-социальная реабилитация больных с экстрофией мочевого пузыря.
Заключение
Сложности ранней диагностики связаны с невыраженными УЗ-проявлениями достаточно тяжелой патологии. Четкое соблюдение алгоритма скрининговых УЗ-исследований анатомии плода в 11-14 и 20-22 нед беременности позволяет диагностировать экстрофию мочевого пузыря. При выявлении экстрофии мочевого пузыря у плода необходимо проведение медико-генетического консультирования с оформлением пренатального консилиума. Требуется тщательное разъяснение родителям сути выявленной патологии, а также информация о частых послеоперационных отдаленных последствиях и осложнениях как физического, так и психогенного генеза.
Литература
- Лопаткин Н.А., Пугачев А.Г. Пороки развития мочевого пузыря и уретры. В кн. Детская урология. Руководство. М.: Медицина, 1986. С. 207-242.
- Gearhart J.P. Criteria for the prenatal diagnosis of classic bladder exstrophy / J.P. Gearhart, J. Ben-Chaim, R.D. Jeffs // Obstet. Gynecol. 1995. Jun. 1. V. 85. № 6. P. 961-964.
- Михельсон А.И. Оперативное лечение недержания мочи на почве врожденных аномалий мочевой системы. Минск, Госсиздат БССР. 1957.
- Осипов И.Б. Реконструктивно-пластические операции при экстрофии мочевого пузыря у детей: автореф. дисс. докт. мед. наук. СПб, 1996.
- Ахунзянов А.А. Диагностика и лечение врожденной клоаки у детей // Хирургия. 1976. № 9. С. 98-101.
- Захаров Н.Л. Дефекты передней брюшной стенки у новорожденных // Хирургия. 1986. № 6.
- Hollowell J.G., Ransley P.G. Surgical management of Incontinence in bladder exstrophy // Brit. J. Urol. 1991. V. 68. № 5. P. 543-548.
- Kockum C.C., Hansson E.E., Stenberg A.et. al. Bladder exstrophy in Sweden-a long-term follow-up study // Eur. J. Pediatr. Surg. 1996. V. 6. P. 208-211.
- Баиров Г.А., Ахметджанов И.А., Осипов И.Б. Реконструктивно-пластические операции при экстрофии мочевого пузыря у детей // Вестник хирургии. 1986. Т. 136. № 6. С. 105-108.

УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Источник
Экстрофия мочевого пузыря (Выворот мочевого пузыря, Эктопия мочевого пузыря)
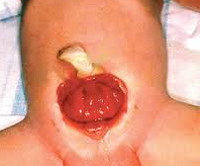
Экстрофия мочевого пузыря – это порок развития мочеполовой системы, при котором формирование мочевого пузыря и передней брюшной стенки в его проекции остается незавершенным. С рождения наблюдается открытая и вывернутая наружу слизистая оболочка задней стенки мочевого пузыря, а также постоянное отделение и стекание мочи из открывающихся в нижней части органа протоков мочеточников. Экстрофия мочевого пузыря часто сочетается с пороками наружных и внутренних половых органов, мочеточников и почек. Диагностируется по характерным внешним признакам, дополнительно проводится рентгенологическое и УЗИ-обследование. Лечение оперативное, выполняются реконструктивно-пластические и заместительные операции.
Общие сведения
Экстрофия мочевого пузыря – одна из наиболее часто встречаемых аномалий развития мочеполовой системы. Частота в популяции – 1 случай на 30-50 тысяч новорожденных, примерно 1/5 часть пациентов имеет сочетанные пороки развития. В большей степени страдают мальчики, по данным разных авторов распространенность патологии среди них в 2-6 раз выше, чем среди девочек.
Специалисты в сфере педиатрии и хирургии сталкиваются с большими трудностями в лечении экстрофии мочевого пузыря, хотя первые операции для коррекции этой аномалии были предложены еще в 1960-х годах. Реконструкция и пластика не приводят к излечению. Сохраняющееся недержание мочи значительно ухудшает качество жизни ребенка, а частые восходящие инфекции становятся причиной хронической почечной недостаточности, представляющей серьезную опасность для жизни.
Экстрофия мочевого пузыря
Причины
Конкретной причины данной аномалии развития не выявлено, патология считается мультифакториальной. Доказана генетическая предрасположенность к некоторым сочетанным порокам органов брюшной полости, в числе которых присутствует и экстрофия мочевого пузыря. Кроме того, повышает риск развития аномалии воздействие различных токсических и инфекционных агентов во время беременности, в частности, курение, внутриутробные инфекции, некоторые медикаменты и т. д. Травмы плода также могут способствовать нарушению правильного эмбриогенеза с развитием пороков.
Патогенез
Основной патогенетический момент экстрофии мочевого пузыря – задержка обратного развития клоакальной перегородки, которая препятствует внедрению мезодермального листка между наружным и внутренним эмбриональными слоями. Это приводит к тому, что процесс формирования стенок мочевого пузыря оказывается незавершенным, и орган остается открытым и вывернутым наружу. Описанные процессы в норме протекают на 4-6 неделе эмбрионального развития, поэтому воздействие тератогенных факторов наиболее опасно в самом начале беременности. Впрочем, это касается не только экстрофии мочевого пузыря, но и большинства пороков развития.
Симптомы
Проявления порока визуально заметны сразу после рождения. Неонатолог при осмотре новорожденного обращает внимание на ярко-красную слизистую оболочку мочевого пузыря, которая замещает отсутствующую часть передней брюшной стенки. Слизистая, как правило, имеет обычную морфологию, но возможно и псевдопапилломатозное изменение. В нижней части заметны отверстия мочеточников, из которых постоянно выделяется моча.
С течением времени основной проблемой при экстрофии мочевого пузыря становится раздражение окружающих тканей мочевыми солями, постоянная мацерация вокруг открытого участка и в области бедер. Инфицирование слизистой оболочки мочевого пузыря является причиной восходящей инфекции мочеточников и почек.
Экстрофия мочевого пузыря часто сочетается с аномалиями верхних мочевыводящих путей. Кроме того, экстрофии всегда сопутствует расхождение лобкового симфиза. Вследствие анатомических различий у мальчиков и девочек наблюдаются разные изменения в соседних органах. У мальчиков встречается расщепление пещеристых тел или их редукция, у девочек – расщепление клитора, аномалии развития влагалища.
Диагностика
В последние годы активно развиваются методы антенатальной диагностики данного порока. Экстрофия мочевого пузыря может быть заметна уже на втором УЗИ-скрининге, однако такое случается не всегда. Часто аномалия развития обнаруживается только после рождения. Поскольку симптоматика специфична, диагноз не вызывает сомнений.
Обязательно проведение рентгенографии брюшной полости для выявления сочетанных пороков, в первую очередь, в мочевыделительной системе, но также в кишечнике и спинном мозге (наиболее характерные сочетания с экстрофией мочевого пузыря). С этой же целью проводится УЗИ. Рекомендована экскреторная урография, которая позволяет убедиться в целостности и правильном развитии мочеточников и почек.
Лечение экстрофии мочевого пузыря
Лечение оперативное. Тип операции зависит от степени экстрофии мочевого пузыря, а именно – от размеров вывернутой части органа и, соответственно, отсутствующего сегмента передней брюшной стенки, а также от сопутствующих пороков развития. Если размер дефекта не превышает 4 см, проводится реконструктивно-пластическое вмешательство, цель которого – закрытие дефекта с помощью близлежащих тканей и восстановление целостности мочевого пузыря. Этого достаточно, поскольку гистологически орган развит правильно, несмотря на патологию в анатомии.
В случае больших размеров дефекта создается искусственный мочевой пузырь, который может выполнять функцию резервуара и опорожняться по желанию. Также часто мочеточники выводятся в сигмовидную кишку (уретеросигмостомия) — это обязательная мера в случае их расщепления.
Большую проблему для детских хирургов представляет расхождение костей таза при экстрофии мочевого пузыря. Накопленный врачебный опыт говорит о высокой частоте неудовлетворительных результатов операций, что связано с большим количеством сочетанных пороков и значительным дефектом передней брюшной стенки.
Прогноз и профилактика
Прогноз для выздоровления сомнительный. Неоперированные пациенты редко доживают до 10 лет. Что касается успеха оперативного лечения, то 20-80% проведенных вмешательств приводят лишь к незначительному улучшению. Нарушения уродинамики продолжают прогрессировать, сохраняется недержание. Риск развития восходящей инфекции остается высоким.
Профилактика экстрофии мочевого пузыря возможна в антенатальном периоде, еще лучше – на этапе планирования беременности, чтобы максимально исключить воздействие тератогенных факторов, особенно на этапе закладки основных органов и систем, то есть в первые 4-8 недель внутриутробного развития.
Источник
Эписпадия и экстрофия мочевого пузыря — Обзор информации
Аномалии группы «экстрофия эписпадия» представляют собой сочетание ряда пороков, объединённых единой этиологией, и дефекта по вентральной поверхности как минимум части мочевого пузыря и мочеиспускательного канала. Данное определение предложили Герхардт и Джеффе в 1996 г. Проявления аномалии варьируют от клоакальной экстрофии до головчатой эписпадии. Классическая экстрофия мочевого пузыря выражается в отсутствии передней стенки нижней половины живота и передней стенки. Эта болезнь сочетается с эписпадией и расхождением лобкового симфиза, а часто и с одновременным недоразвитием яичек, с крипторхизмом, аплазией одного или двух пещеристых тел, гипоплазией простаты у мальчиков и различными аномалиями половых органов у девочек. Наиболее часто данную аномалию определяют как комплекс «экстрофия эписпадия», включающий такие патологические состояния:
- эписпадия;
- частичная экстрофия;
- классическая экстрофия;
- экстрофия клоаки;
- варианты экстрофии.
Формально впервые подробно описал экстрофию как врождённый порок в 1597 г. Графенберг, хотя упоминания этой аномалии обнаружены на ассирийских табличках, сделанных 2 тыс. лет до н.э. Первые попытки оперативного лечения порока были предприняты в середине XIX в. Хирурги создавали обычный анастомоз между мочевым пузырём и сигмовидной кишкой, но лишь у единичных больных удалось эффективно направить мочу в прямую кишку и при этом скрыть дефект передней брюшной стенки. Одну из первых успешных операции осуществил Эйрс: ему удалось укрыть обнажённую слизистую оболочку и уменьшить боли, связанные с её раздражением. Тренделенбург в 1906 г. сделал попытку закрыть мочевой пузырь, выполнив цистэктомию в сочетании с антирефлюксной урегеросигмосгомией.
1942 г. Янг сообщил о первом успехе — удержании мочи с помощью пластики мочевого пузыря. Вторым этапом шейха мочевого пузыря была сформирована в трубку, и девочка оставалась сухой в течение 3 ч. Однако до 50-х годов прошлого столетия большинство хирургов предпочитали для коррекции экстрофии применять иссечение мочевого пузыря и отведение ночи в кишечник.
О проведении двусторонней подвздошной остеотомии в сочетании с пластикой мочевого пузыря сообщил Шульц в 1954 г. Через неделю после удаления катетера из мочевого пузыря девочка стала удерживать мочу. Таким образом, сближение лонных костей с помощью двусторонней подвздошной остеотомии обеспечивает лучшую функцию механизма удержания мочи с участием мышц урогенитальной диафрагмы. В дальнейшем пластика мочевого пузыря стала более распространенной, особенно после того, как появилось большое количество сообщений о рецидивирующем пиелонефрите и прогрессирующей хронической почечной недостаточности после операции отведения мочи в кишечник. Однако создание механизма приемлемого удержания мочи у пациентов с экстрофией мочевого пузыря остается очень трудной задачей.
В последние десятилетия получила широкое применение этапная реконструкция. Пластика в первые дни после рождения ребёнка облегчает сведение лонных костей без остеотомии и уменьшает диспластические изменения на слизистой оболочке. У 1-2-летних детей при коррекции эписпадии выполняют пластику мочеиспускательного канала и расправление полового члена. Эти процедуры обеспечивают рост мочевого пузыря, необходимый для пластики его шейки. Реконструкция шейки в сочетании с антирефлюксной пересадкой мочеточников в дно детрузора увеличивает объём пузыря, и по окончании этапного лечения пациенты обычно удерживают мочу.
Грэди и Митчелл в 1999 г. предложили объединить первичную пластику с пластикой полового члена и мочеиспускательного канала у новорождённого. Однако из-за значительного увеличения объёма и продолжительности операции данная методика не получила широкого распространения.
Таким образом, современный этап лечения комплекса «экстрофия эписпадия» связан со стремлением хирургов обеспечить приемлемое удержание мочи и формирование половых органов нормального вида без ущерба ренальной и половой функций.
[1], [2], [3], [4], [5], [6], [7], [8], [9]
Источник