Водянка у плода в мочевом пузыре
Содержание статьи
Водянка плода
Водянка плода — это патологическое состояние, которое возникает во внутриутробном периоде, характеризуется анасаркой и скоплением транссудата в полостях организма. Основные клинические проявления: генерализованный отек, увеличение размеров головы за счет мозгового черепа, гидроторакс, гидроперикард, асцит, сердечно-сосудистая и дыхательная недостаточность. Антенатальная диагностика включает в себя УЗИ и определение групп крови, постнатальная — визуальное выявление всех симптомов, характерных для водянки плода, лабораторные анализы, УЗИ, КТ, МРТ. Лечение симптоматическое — реанимационные мероприятия, дренирование транссудата. При иммунной форме показано внутриутробное переливание крови.
Общие сведения
Водянка плода — это полиэтиологическое патологическое состояние в неонатологии и педиатрии, которое характеризуется внутриутробным развитием генерализованного отека, накоплением жидкости в грудной и брюшной полостях, а также в перикардиальной сумке. Общая распространенность — 1:1-14 тысяч новорожденных, при этом иммунная форма встречается 1 раз на 3 000 родов.
Несмотря на относительно большую распространенность АВ0 и резус-конфликтов матери и плода в популяции, развитие иммунной формы водянки плода на этом фоне возникает редко. Это связано с возможностями современной диагностики, внутриутробного лечения и профилактики гемолитической болезни новорожденных. Более чем в половине случаев (55-60%) этиология остается неизвестной. Прогноз при данной патологии всегда серьезный. Летальность для неиммунной формы очень высока и составляет порядка 70-80%, в то время как для иммунной — около 20%.
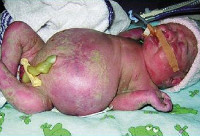
Водянка плода
Причины водянки плода
Водянка плода — это гетерогенное заболевание. Зачастую точную этиологию установить не удается, однако известны наиболее вероятные причины ее развития. Неиммунная форма может быть вызвана:
- мутациями (синдром Дауна, Шерешевского-Тернера, триплоидия и тетраплоидия),
- генетическими заболеваниями (дефицит Г-6-ФДГ, α-таласемия, синдром Нунан и Пена-Шокея и др.), нарушением проводимости и врожденными пороками сердца (ДМПП, ДМЖП, наджелудочковые и желудочковые тахикардии),
- патологиями магистральных сосудов (тромбоз верхней и нижней полых вен, артериовенозное шунтирование),
- аномалией структуры грудной клетки (грыжа диафрагмы и асфиктическая дисплазия),
- TORCH-инфекциями (токсоплазмоз, ЦМВ, сифилис и др.),
- дисплазией мочеполовой системы (врожденный стеноз или аплазия мочеточника, гидронефроз),
- патологиями беременности (синдром плацентарной трансфузии, хориоангиома, эклампсия).
Патогенез неиммунной водянки плода основывается на сердечной недостаточности ребенка, гипопротеинемии и анемии, которые уменьшают онкотическое давление крови.
Факторы риска
Помимо всех вышеперечисленных причин развития водянки плода, можно выделить факторы риска, которые повышают риск возникновения неиммунной формы. К ним относятся:
- беременность до 16 или после 40 лет,
- многоплодная и переношенная беременность,
- макросомия,
- мужской пол
Основная причина иммунной водянки плода — несовместимость матери и плода по группе крове (0 (I) у матери и А (II) или В (III) — у ребенка) или Rh-фактору (мать — Rh+, а ребенок — Rh-), вследствие чего возникает усиленный гемолиз эритроцитов ребенка и развивается гемолитическая болезнь. На данный момент этот вариант встречается крайне редко в связи с общепринятыми диагностическими мерами в акушерстве.
Классификация
Водянка плода имеет две этиологические формы:
- Иммунная водянка плода. Как правило, развивается на фоне гемолитической болезни новорожденного. В настоящее время на фоне ранней диагностики и лечения данная форма водянки плода практически не встречается, несмотря на относительно большую распространенность резус- и АВ0-конфликтов. Прогноз относительно благоприятный.
- Неиммунная форма. Полиэтиологическая группа. Данный вариант водянки плода может быть вызван врожденными пороками сердца и нарушением работы его проводящей системы, геномными и хромосомными мутациями, TORCH-инфекциями, разнообразными дисплазиями, патологиями беременности и др. В большинстве случаев имеет летальный исход.
Симптомы водянки плода
Клинические проявления водянки плода определяются уже с момента рождения. Общее состояние ребенка, как правило, тяжелое или очень тяжелое (чаще). У таких детей выявляется несоразмерно большая голова за счет значительного увеличения мозговой части черепа. Из-за общей мышечной слабости ребенок занимает позу лягушки. Швы черепа разомкнуты, роднички выпирают, кости имеют податливую консистенцию. На теле определяется большой объем сыровидной смазки и множество пушковых волос, обнаруживается общая отечность и бледность. Подкожная жировая клетчатка выражена слабо, из-за чего температура тела очень лабильна и сильно зависит от окружающей среды.
При водянке плода у мальчиков может наблюдаться крипторхизм, а у девочек — недоразвитость половых губ. Физиологические рефлексы (в т. ч. сосательный и поисковый, Моро) угнетены. ЧЧС лабильное (120-160 уд/мин), АД ниже нормы (50-65 мм. рт. ст.). Наблюдается тахипноэ, чередующееся с периодами апноэ. Часто отмечается выраженная гепатоспленомегалия, гидроторакс, асцит, гидроперикард. В некоторых случаях может формироваться транзиторный гипотиреоз и поллакиурия.
Диагностика
Диагностика водянки плода включает в себя сбор анамнестических данных, объективный осмотр ребенка, лабораторные и инструментальные методы исследования. При опросе матери обращают внимание на перенесенные инфекционные и гинекологические заболевания, хронические патологии, особенности течения беременности и ее осложнения.
- При объективном осмотре неонатологом или педиатром устанавливаются характерные симптомы водянки плода, присутствующие осложнения, оценивается общее состояние ребенка и необходимость реанимационных мероприятий.
- Лабораторная диагностика в виде ИФА, ПЦР или других серологических реакций дают возможность выявить вероятного инфекционного возбудителя. При подозрении на гемолитическую болезнь плода проводится повторное определение группы крови и Rh-фактора матери и ребенка. Общие лабораторные тесты (ОАК, ОАМ, биохимия крови) используются с целью оценки работы внутренних органов и исключения сопутствующих заболеваний.
- Ультразвуковое сканирование позволяет поставить предварительный диагноз еще в антенатальном периоде. К УЗ-признакам, которые могут указывать на водянку плода, относятся отечность плаценты, многоводие, наличие жидкости в полостях организма ребенка, гепатоспленомегалия, отек подкожной жировой клетчатки, «поза Будды». Постнатальное УЗИ выполняется для подтверждения опасных патологических состояний (гидроперикард, гидроторакс, асцит) и определения терапевтической тактики.
- Также могут применяться ЭКГ, компьютерная и магнитно-резонансная томография с целью дифференциальной диагностики и оценки структуры внутренних органов.
Лечение водянки плода
Специфического лечения неиммунной водянки плода нет. Роды проводятся в условиях полной готовности реанимационного оборудования. Непосредственно после рождения ребенку оказывается полный объем интенсивной терапии: интубация трахеи с подачей 100% кислорода, при необходимости — сердечно-легочная реанимация, переливание крови или эритроцитарной массы и т. д. При неэффективности всех проводимых мероприятий показано выполнение плевральной, перикардиальной пункций и лапароцентеза под контролем УЗИ и жизненно-важных показателей ребенка. В зависимости от ситуации может назначаться антигеморрагическая, антибактериальная, иммунокорригирующая, метаболическая, противосудорожная терапия и пр.
При иммунной форме водянки плода лечение начинается еще в антенатальном периоде. Оно заключается во внутриутробном переливании Rh- крови плоду при помощи кордоцентеза. Показана данная процедура при выраженной анемии и падении гематокрита ниже 30 г/л. При необходимости может проводиться повторное переливание через 14-21 дней.
Прогноз и профилактика
Прогноз при неиммунной водянке плода в большинстве случаев неблагоприятный. Выживаемость составляет не более 20-30% от общего числа новорожденных с данной патологией. При возникновении неиммунной водянки в первой половине гестации имеется высокий риск спонтанного прерывания беременности, во второй — внутриутробной гибели ребенка. При иммунной водянке плода исход более благоприятный — на фоне лечения выживают порядка 85% детей.
Специфическая профилактика может проводиться только по отношению к иммунной форме водянки плода. Она показана при подтвержденной несовместимости крови матери и ребенка. Ее суть заключается во введении матери иммуноглобулинов, которые будут препятствовать гемолизу эритроцитов плода. Неспецифические превентивные меры заключаются в рациональном планировании беременности, полноценном обследовании во время вынашивания ребенка, регулярном посещении женской консультации, лечении соматических и инфекционных заболеваний матери.
Водянка плода — лечение в Москве
Источник
Водянка плода
Автор: Созинова А.В., акушер-гинеколог, ведет непрерывную практику с 2001 года.
Водянкой плода называется его патологическое состояние, при котором во всех полостях организма скапливается жидкость и присутствует генерализованный отек (отеки всего тела — анасарка).
В большинстве случаев водянка плода наблюдается при резус-конфликтной беременности и гемолитической болезни новорожденного. Распространенность данного состояния составляет 1 случай на 1000-14000 родов. Различают иммунную и неиммунную водянку плода.
Причины
Основной причиной развития иммунной водянки плода служит его гемолитическая болезнь.
Причина, которая привела к развитию неиммунной водянки плода зачастую остается нераспознанной, но выделяют следующие факторы:
- хромосомная патология плода (синдром Дауна, мозаицизм, трисомии, синдром Шерешевского-Тернера и прочие);
- генные заболевания: недостаток глюкозо-6-фосфатдегидрогеназы, А-талассемия, синдром Нунан, ахондрогенез, танатофорная карликовость, синдром Пена-Шокея, синдром множественных птеригиумов, ахондроплазия;
- пороки развития грудной полости (дисплазия грудной клетки, диафрагмальная грыжа, порок легкого кистозный аденоматозный);
- пороки развития мочевыделительной системы (врожденный нефротический синдром, пороки уретры и почек);
- сердечно-сосудистая патология (кардиомиопатия, врожденные пороки сердца, анатомические дефекты, артериально-венозные шунты)
- хориоангиома плаценты;
- при многоплодной беременности (фето-фетальная трансфузия, акардиальная двойня);
- инфекционные заболевания матери во время беременности (цитомегаловирусная инфекция, сифилис, парвовирусная инфекция, токсоплазмоз, вирусный панкардит Коксаки);
- осложнения беременности (преэклампсия, тяжелая анемия, нескоррегированный сахарный диабет, гипопротеинемия);
- врожденные обменные нарушения (мукополисахаридоз 4 типа, болезнь Гоше, дефицит нейраминидазы, болезнь Моркио);
- врожденные опухоли головного и спинного мозга, мочевыделительной системы и пищеварительного тракта, печени, крестцово-копчиковая тератома, нейробластома.
Диагностика
Диагностика водянки плода направлена на установление причины, его вызвавшей. В первую очередь определяется группа крови и резус-фактор для подтверждения/исключения резус-конфликта и иммунной водянки плода.
Проводится анализ анамнеза жизни (инфекционные болезни в прошлом, операции, хроническая патология), акушерско-гинекологического анамнеза (наличие гинекологических патологий, течение и исходы предшествующих беременностей), анализируется течение настоящей беременности, ее осложнения, общая прибавка веса и прочее.
Главным диагностическим методом служит УЗИ плода. К УЗИ-признакам относятся:
- отечность плаценты («толстая плацента»);
- избыток амниотической жидкости (многоводие);
- размеры плода больше нормы из-за отека (в частности увеличенные размеры живота вследствие асцита по сравнению с размерами головки);
- скопление жидкости во всех полостях плодового организма (гидроперикард, асцит, гидроторакс)
- отек подкожно-жирового слоя в виде двойного контура;
- отек кожи головы, рук и ног;
- кардиомегалия (увеличение размеров сердца);
- утолщение кишечника (отек стенок);
- увеличение печени и селезенки (гепатоспленомегалия)
- «поза Будды» — раздутый живот с отведенными от него конечностями и позвоночником;
- низкая двигательная активность в сочетании с другими признаками.
После проведения УЗИ назначается амнио- или кордоцентез для определения кариотипа плода, получения крови плода (оценка гемоглобина, белка) и возможного внутриутробного лечения. С целью исключения внутриутробной инфекции назначается ПЦР на предполагаемые инфекции.
Лечение водянки плода
При выявлении врожденных пороков развития плода, несовместимых с жизнью (1-2 триместр беременности) женщине предлагают прерывание беременности. В случае отказа от прерывания продолжают наблюдать за течением беременности и развитием болезни до сроков, позволяющих проводить пренатальную (дородовую) терапию.
Лечение водянки плода заключается в проведении кордоцентеза и переливания крови в пуповину (в случае выраженной анемии и снижения гематокрита до 30 и ниже). При необходимости заменное переливание крови повторяют через 2-3 недели.
В случае выявления фето-фетальной трансфузии близнецов проводится лазерная коагуляция сосудов, соединяющих плоды. Если нет возможности провести пренатальное лечение, оценивается степень риска преждевременных родов по отношению к антенатальной гибели плода и родоразрешение проводят досрочно с предварительным назначением препаратов для ускорения созревания легких плода. В некоторых случаях показано введение матери сердечных гликозидов для нормализации сердечной деятельности плода.
Перед родоразрешением (оно, как правило, происходит планово) готовятся к рождению ребенка с водянкой. Родильный зал должен быть оснащен аппаратурой для сердечно-легочной реанимации, формируется реанимационная бригада из 2-3 реаниматологов и 2-3 неонатологов (после рождения ребенка сразу интубируют и осуществляют искусственную вентиляцию легких 100% кислородом).
Сразу после рождения и проведения реанимационных мероприятий выполняется перикардиоцентез (удаление путем пункции околосердечной сумки накопившейся жидкости), плевральную пункцию (удаление жидкости из плевральной полости) и лапароцентез (высасывание жидкости из брюшной полости). В пупочную артерию устанавливается катетер для последующих инфузий эритроцитарной массы или крови.
Прогнозы
Прогноз при неиммунной водянке плода неблагоприятный и процент выживших детей составляет 20-33%. При развитии водянки в первом триместре беременность, как правило, заканчивается спонтанным абортом, во втором и третьем триместрах высок риск антенатальной гибели плода.
При иммунной водянке прогноз более утешительный, эффект от пренатального и постнатального лечения достигает 80-90%.
Некоторые исследования при беременности
- Мазки при беременности
- Анализы при беременности по триместрам
- УЗИ при беременности
- Общий анализ мочи при беременности
- Коагулограмма
- Установка пессария
- Глюкозотолерантный тест
- Гомоцистеин при беременности
- Амниоцентез
- Анестезия в родах
- КТГ плода (кардиотокография)
- Кордоцентез
- Эпидуральная анестезия в родах
Источник
Неиммунная водянка плода. Современный взгляд на проблемы этиологии, патогенеза и перинатального исхода
Неиммунная водянка плода (НВП) — гетерогенное расстройство, являющееся заключительной стадией некоторых внутриутробных заболеваний плода, характеризующееся скоплением транссудата и выраженным отеком тканей. Частота НВП, по разным данным [1, 2], составляет от 0,05 до 0,5%.
В связи с широким распространением ультразвукового исследования в большинстве случаев неиммунную водянку диагностируют пренатально. Критерием постановки диагноза является избыточное скопление жидкости в двух или более областях тела (грудная клетка, брюшная полость, перикард, кожа). Часто НВП сопровождается многоводием [3].
НВП — финальный этап болезни, после которой наступает летальный исход. Смертность при НВП, по некоторым данным [4], достигает 90%.
Согласно результатам крупного систематического обзора [5], основанного на анализе 51 исследования (5437 пациенток), среди причин НВП преобладает сердечно-сосудистая патология — 21,7% случаев. 13,4% случаев НВП связаны с хромосомными аномалиями и 4,4% — с синдромальными формами множественных пороков развития, 10,4% — с гематологическими заболеваниями, 6% — с заболеваниями легких и грудной клетки, 5,7% — с заболеваниями лимфатической системы, 2,3% — с патологией мочевыводящей системы. Фактором риска развития НВП является синдром фетофетальной трансфузии при монохориальной двойне. Частота НВП при данном осложнении составляет 5,6%. Инфекционные процессы и в первую очередь парвовирусная инфекция являются причиной НВП в 6,7-27% случаев [6]. В 17,8% случаев причину НВП выявить не удается, и водянку расценивают как идиопатическую.
НВП при врожденных пороках сердца (ВПС) является результатом сердечной недостаточности у плода. Среди механизмов сердечной недостаточности при ВПС значительное место занимает неадекватное внутрисердечное распределение венозного возврата. Также относительно высока частота диастолической дисфункции сердца. Нередко прогрессированию сердечной недостаточности способствуют врожденные нарушения ритма. Причины, приводящие к сердечной недостаточности при ВПС, можно объединить в три основные группы: 1) нагрузка большими объемами перекачиваемой крови: ВПС с большими дефектами межжелудочковой перегородки (ДМЖП), открытый артериальный проток (ОАП), тотальный аномальный дренаж легочных вен, недостаточность клапанов сердца; 2) критическая нагрузка сопротивлением (аортальный стеноз, коарктация аорты, легочный стеноз); 3) гипоксическое или ишемическое повреждение миокарда (транспозиция магистральных артерий, аномальное отхождение коронарной артерии).
Причиной неиммунной водянки плода являются такие ВПС, как преждевременное закрытие овального окна, полная форма атриовентрикулярного канала, стеноз аорты, аномалия Эбштейна, опухоли сердца, а также нарушения сердечного ритма (наджелудочковые тахикардии, трепетание, блокады, брадиаритмии, синдром Вольфа-Паркинсона-Уайта).
Аномалия Эбштейна — врожденный порок сердца, характеризующийся аномальным развитием и расположением створок трикуспидального клапана. При аномалии Эбштейна септальный и задний паруса трехстворчатого клапана развиваются непосредственно из эндокарда правого желудочка сердца, что приводит к смещению аномального клапана в глубь правого желудочка и разделению желудочка на два отдела: дистальный (подклапанный) — активный и проксимальный (надклапанный или атриализованный) — пассивный. Надклапанный отдел, соединяясь с правым предсердием, формирует единое функциональное образование. Аномалия Эбштейна составляет 0,04% от всех ВПС, 0,4% среди критических ВПС и почти всегда сопровождается кардиомегалией. Гемодинамические нарушения при данном пороке определяются степенью смещения створок клапана, регургитацией и затруднениями легочного кровотока. Наиболее ранняя пренатальная ультразвуковая диагностика аномалии Эбштейна была осуществлена в 18-19 нед беременности. При исследовании в проекции 4 камер определяется смещение септальной створки в полость правого желудочка. Имеется дистанция между смещенным клапаном и трикуспидальным кольцом, соответствующая атриализированой части правого желудочка. Степень кардиомегалии тесно связана с выраженностью трикуспидальной регургитации. У 90% больных с аномалией Эбштейна выявляются ДМЖП или открытое овальное окно. Более редко наблюдаются такие пороки, как стеноз легочной артерии или ее атрезия, ОАП, двустворчатый аортальный клапан. Аномалия Эбштейна нечасто сочетается с хромосомными аберрациями. Экстракардиальные аномалии наблюдают в 25% случаев. При наличии трикуспидальной недостаточности порок может существенно нарушать гемодинамику плода с развитием сердечной недостаточности, водянки плода и его гибели [7]
Открытый антриовентрикулярный канал (АВК) — патология, характеризующаяся комбинацией первичного дефекта межпредсердной перегородки, дефекта приточной части межжелудочковой перегородки и дефектов формирования левого и правого атриовентрикулярных клапанов. Из спектра нарушений выделяют частичную (неполную) форму, промежуточную и полную форму атриовентрикулярного канала. Частота порока составляет 0,25 на 1000 живорожденных, около 4% — среди всех ВПС и 6% — среди критических ВПС. Примерно у 50% новорожденных АВК сочетается с синдромом Дауна, а в 13-18% случаев с другими пороками и аномалиями сердца (тетрада Фалло, атрезия легочной артерии, коарктация аорты, предсердный изомеризм и т.п.). Гемодинамические изменения связаны с шунтированием крови на уровне межпредсердной и межжелудочковой перегородок и с недостаточностью атриовентрикулярных клапанов. В результате порока возникает левоправый сброс крови в легочную артерию, объемная перегрузка правых и левых отделов сердца и легочная гипертензия. Полная форма АВК в большинстве случаев создает нагрузку на сердце уже внутриутробно и может приводить к сердечной недостаточности и водянке плода.
Аортальный стеноз — обструкция выхода из левого желудочка на клапанном, надклапанном или подклапанном уровне. Частота порока составляет 0,04-0,48 на 1000 новорожденных, 2-8% — среди всех ВПС и 2,5% — среди критических ВПС. Аортальный стеноз затрудняет выброс крови в аорту, особенно в ответ на физическую нагрузку. В результате возникает компенсаторная гипертрофия левого желудочка. Умеренная обструкция левого желудочка приводит к его дилатации. В случае же критического аортального стеноза рост и развитие желудочка резко замедляются, значительно расширяется левое предсердие. Водянка развивается приблизительно у 30% плодов с критическим аортальным стенозом.
Опухоли сердца представляют собой редкие врожденные пороки. Около 85% всех новообразований составляют рабдомиома, фиброма, тератома. Наиболее частой опухолью сердца является рабдомиома (60-70%). В раннем периоде беременности — до 8 нед, опухоль, расположенная в стратегически важных зонах, может влиять на развитие соответствующих отделов сердца (межжелудочковая перегородка, выводные отделы желудочков, клапаны сердца), перераспределение потоков крови и способствовать развитию ВПС. Кроме того, при уменьшении в размерах и даже полном исчезновении рабдомиомы и уменьшении симптомов обструкции или аритмии связанные с ней ВПС сохраняются. Нередко на фоне рабдомиомы развивается сердечная недостаточность и водянка плода.
Преждевременное закрытие овального окна
Как известно, во внутриутробном периоде наличие межпредсердного сообщения является обязательным условием нормального развития плода. Преждевременно закрытие его приводит к перегрузке правых и гипоплазии левых отделов сердца, сердечной недостаточности и водянке плода [8]. Одной из возможных ятрогенных причин преждевременного закрытия овального окна является длительное применение токолитической терапии нестероидными противовоспалительными средствами во II и III триместрах беременности.
Следующая группа причин НВП связана с аномалиями развития грудной клетки: врожденный кистозно-аденоматозный порок развития легкого, бронхолегочная секвестрация, диафрагмальная грыжа.
Секвестрация легкого — порок развития, при котором часть аномально развитой легочной паренхимы отделяется от неизмененного легкого. При аномалиях кровоснабжения измененного участка постепенно у плода формируется лево-правый шунт, который влечет за собой развитие неиммунной водянки.
Кистозно-аденоматозный порок развития легкого (КАПРЛ) — аномалия, характеризующаяся разрастанием терминальных бронхиол с образованием кист разного размера, не затрагивающих альвеолы. Формируется в середине I триместра, когда происходит образование воздухоносных путей из эндодермы (первичная кишка) и дыхательного компонента из мезенхимы. В результате задержки объединения этих двух эмбриональных структур и последующего разрастания терминальных бронхиол возникает КАПРЛ. Иммуногистологические исследования показали, что в участке легкого с кистозно-аденоматозными изменениями существует несоответствие между активной эпителиальной пролиферацией и бедной васкуляризацией легочной ткани. Частота КАПРЛ до конца не установлена в связи с его редкостью.
В 58% случаев КАПРЛ приводит к смещению средостения, что может быть причиной сдавления сердца и центральных вен, в результате чего развивается вторичная сердечная недостаточность, проявляющаяся НВП. Частота НВП при КАПРЛ варьирует, по разным данным [9], от 12 до 47% наблюдений.
Развитие пренатальной медицины позволило накопить опыт дородового хирургического лечения КАПРЛ. Для прогнозирования течения заболевания и определения целесообразности оперативного лечения используют соотношение размеров поражения с окружностью головы плода (CVR — CCAM Volume Ratio — объемное отношение КАПРЛ). Если CVR превышает 1,6, риск НВП составляет 80%, и внутриутробное оперативное вмешательство считают оправданным [10]. Наибольшая серия пренатального оперативного лечения (удаление пораженной доли легкого) описана S. Mann и соавт. [11]. По мнению авторов, пренатальное хирургическое лечение следует проводить в тех случаях, когда перспективы вынашивания сомнительны, в частности, при присоединении НВП. По их данным, 10 (63%) из 16 плодов с водянкой, оперированных в пренатальном периоде, выжили. Возможна также пункция или дренирование кистозных полостей из миниинвазивного доступа. R. Wilson и соавт. [12] описали серию из 10 случаев торакоамниотического шунтирования при КАПРЛ в сроке 20 нед беременности. Выживаемость составила 70% (7 из 10).
Врожденная диафрагмальная грыжа — порок, возникающий в результате замедления процесса закрытия плевроперитонеального канала. При данном пороке обычно имеет место недостаточность развития заднелатерального участка левой половины диафрагмы. Отсутствие разделения между брюшной полостью и грудной клеткой приводит к перемещению желудка, селезенки, кишечника и даже печени в грудную полость, что может сопровождаться смещением средостения и вызывать сдавление легких. Вследствие этого нередко развивается двусторонняя легочная гипоплазия с аномальным формированием сосудистой системы и вторичной легочной гипертензии. Врожденная диафрагмальная грыжа встречается приблизительно у 1 из 2400 новорожденных. Сочетанные аномалии наблюдаются у 15-30% плодов. Среди них превалируют врожденные пороки сердца — 16%, пороки ЦНС и мочевыделительной системы — 11%. В 12% наблюдений диафрагмальные грыжи входят в состав хромосомных и нехромосомных синдромов. НВП при диафрагмальной грыже встречается в 15% случаев [13].
В генезе НВП важную роль играет парвовирусная инфекция, которую выявляют методом ПЦР-диагностики — 18-27% всех случаев неиммунной водянки плода [14]. Описано несколько механизмов развития водянки плода при парвовирусной B19-инфекции у матери. Поскольку плод растет очень быстро, а период жизни эритроцитов короткий, то плод чрезвычайно зависим от адекватной продукции эритроцитов для нормальной оксигенации органов и тканей. Тяжелая В19-инфекция плода является причиной тяжелой анемии и гипоксии, выраженной сердечной недостаточности и водянки. Еще одной причиной водянки плода может служить развитие В19-миокардита без тяжелой анемии. Эти плоды выздоравливали самостоятельно, без заменного переливания крови. Следует отметить, что риск развития водянки плода при острой парвовирусной инфекции во время беременности невелик и составляет около 1% при острой В19-инфекции, перенесенной во II и III триместрах [15, 16]. Инфицирование плода происходит в ¼ случаев материнской инфекции. Таким образом, у большинства плодов инфекция разрешается без каких-либо последствий [17]. Исследование патофизиологических механизмов развития водянки плода при парвовирусной инфекции показало, что критическим периодом инфицирования беременной является срок 13-16 нед, это совпадает с периодом максимального фетального гемопоэза. 85% случаев инфекции плода развиваются в течение 10 нед от момента инфицирования матери (в среднем 6-7 нед). В 80% случаев водянка плода была диагностирована во II триместре — в 22-23 нед [18]. Хотя таких исследований крайне мало, можно сделать вывод, что в большинстве случаев дети, рожденные от матерей с острой В19-инфекцией, не имеют в дальнейшем отклонений в развитии [19].
Другими инфекционными причинами НВП могут быть токсоплазмоз, сифилис, цитомегаловирусная инфекция, листериоз, вирусный гепатит, краснуха, лептоспироз [20]. Описан также редкий случай развития НВП на фоне рецидивирующей герпесвирусной инфекции 2-го типа [21].
Причиной водянки плода могут стать и плацентарные нарушения: хориоангиомы, артериовенозные шунты, травмы плаценты.
Реже причиной НВП являются гематологические заболевания и в первую очередь альфа-талассемия. Последняя может иметь различные проявления в зависимости от того, сколько из четырех генов, отвечающих за синтез α-глобиновых цепей, будет вовлечено в патологический процесс. Есть всего 4 локуса, кодирующих α-цепи. Наличие мутации в одном из локусов приводит к минимальным клиническим проявлениям. Нарушения в двух локусах выражаются легкой формой анемии. При мутациях в трех локусах возникает значительное уменьшение продукции α-глобина. При этом избыточные цепи β-глобина образуют тетрамеры — гемоглобин Н. Эта форма носит также название гемоглобинопатии Н. Характер заболевания может варьировать от легкой до тяжелой гипохромной микроцитарной анемии. Присутствие мутаций во всех четырех аллелях α-глобина несовместимо с жизнью (так называемый гемоглобин BART). Данное заболевание сопровождается развитием неиммунной водянки, которая приводит к гибели плода между 28-й и 37-й неделями беременности.
НВП часто сопровождается преждевременными родами. По данным L. Wu и соавт. [22], на фоне НВП в 2,3 раза возрастает риск преэклампсии. Описано также редкое осложнение НВП — материнский зеркальный синдром (синдром Ballantyne) — тяжелый полисерозит с периферическими отеками матери, сопровождающий НВП, причиной которого могут быть сосудистые нарушения в отечной плаценте или избыточная продукция антиангиогенных факторов гипертрофированной плацентой [23].
Диагностика неиммунной водянки плода
Ультразвуковая диагностика неиммунной водянки основана на обнаружении патологической жидкости и накоплении ее по меньшей мере в двух различных полостях тела плода, с развитием отека подкожной клетчатки не менее 5 мм. Нередко НВП сопровождается плацентомегалией с толщиной ткани не менее 5 см, а также многоводием.
В некоторых ситуациях ультразвуковая диагностика позволяет выявить и причину НВП: пороки сердца, легких, фето-фетальная трансфузия, аритмия или тяжелая анемия. Косвенным признаком анемии плода является повышение пиковой скорости кровотока в средней мозговой артерии.
Помощь в диагностике этиологии НВП может оказать серологическое исследование крови на сифилис, токсоплазмоз, цитомегаловирус, краснуху, парвовирус В19, а также кордоцентез, позволяющий провести кариотипирование плода и выявить признаки внутриутробной инфекции.
Тактика ведения и прогноз
Лишь в очень редких случаях при НВП возможно хирургическое лечение. Серьезного улучшения можно добиться у плодов с КАПРЛ при внутриутробном удалении пораженной доли легкого. Кроме того,
W. Peranteau и соавт. [24] на небольшой выборке пациенток с КАПРЛ и НВП показали, что у таких плодов существенно увеличивается выживаемость при антенатальной терапии бетаметазоном, однако контролируемых исследований по этому поводу до настоящего времени не проводилось. При некоторых видах тахиаритмий возможна фармакологическая терапия. Тяжелую анемию плода можно компенсировать внутриутробным переливанием эритроцитной массы. Водянка одного плода из двойни при фето-фетальной трансфузии может разрешиться после коагуляции анастомозов.
В большинстве же случаев НВП является фатальным состоянием и вести эту патологию следует выжидательно. НВП с течением времени, как правило, сохраняется в неизменном состоянии или постепенно нарастает, однако описаны случаи и спонтанного ее разрешения [25].
Информация о прогнозе для плодов с неиммунной водянкой крайне скудна, в связи с высокой смертностью. Уровень смертности напрямую зависит от причины НВП. Развитие НВП при наличии множественных пороков сердца сопровождается максимальной смертностью. Гораздо благоприятнее прогноз при НВП на фоне инфекционных процессов [26]. При этом, чем позднее развивается это состояние, тем лучше прогноз. Так, если НВП развивается до 24 нед, перинатальная смертность превышает 95%, а из эуплоидных плодов без структурных аномалий сердца, доживших до 24 нед, выживают около 20% [27].
Вскрытие требуется для всех случаев неиммунной водянки, которые стали причиной смерти плода или новорожденного. Патологоанатомическое заключение будет способствовать не только определению этиологии неиммунной водянки, но и послужит основой для дальнейшего генетического консультирования родителей и прогнозирования рецидивов [28]. Рецидивы идиопатической неиммунной водянки плода редки, хотя были зарегистрированы серии случаев повторения НВП при последующих беременностях. У одной женщины описаны даже три последовательных беременности, осложненных идиопатической НВП [29].
Таким образом, при выявлении НВП пациентка должна быть направлена в стационар третьего уровня для комплексного обследования и, по возможности, выявления причины НВП. Ультразвуковое исследование плодов должно включать тщательную эхокардиографию и допплерометрическое исследование с определением пиковой скорости кровотока в средней мозговой артерии (маркер анемии плода). В некоторых ситуациях выявление причины позволит провести соответствующее лечение. Так, при выявлении признаков анемии у плода возможно внутриутробное переливание крови. При обнаружении НВП следует рекомендовать проведение кордоцентеза и кариотипирования плода для исключения хромосомных аномалий. Кроме того, во всех случаях необъяснимой НВП мать следует обследовать на инфекции и α-талассемию [30].
Источник