Таргетная терапия при раке мочевого пузыря
Содержание статьи
«Падсев»: мощное таргетное лечение рака мочевого пузыря | МОСМЕДПРЕПАРАТЫ
Коротко
- Японская «Астеллас фарма» (Astellas Pharma) и «Сиэтл джинетикс» (Seattle Genetics) заручились одобрением Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) на «Падсев» (Padcev, энфортумаб ведотин) — новый лекарственный препарат, предназначенный для терапии взрослых пациентов с местнораспространенным или метастатическим уротелиальным раком, которые ранее проходили терапию блокаторами PD-(L)1 и платиносодержащими химиопрепаратами при неоадъювантном/адъювантном, местнораспространенном или метастатическом показании. Регуляторное решение выдано условно, то есть новинке еще предстоит окончательно подтвердить собственную эффективность.
- Уротелиальный рак, или уротелиальная (переходно-клеточная) карцинома, — тип онкологии, который затрагивает мочевыделительную систему. В 90% случаев речь идет о раке мочевого пузыря, остальные приходятся на почечную лоханку (8%), мочеточник и уретру (2%). В 2018 году в мире было поставлено почти 550 тыс. диагнозов рака мочевого пузыря — он занял десятое место в списке самых распространенных онкологических заболеваний. При этом в Соединенных Штатах и Европе рак мочевого пузыря находится на пятом месте по частоте встречаемости.
- Местнораспространенная или метастатическая уротелиальная карцинома — неизлечимое онкологическое заболевание, характеризующееся плохой долгосрочной выживаемостью. Платиносодержащая терапия показана в первоочередном лечении большинства пациентов: на нее отвечают 41–50% больных, а медиана выживаемости без прогрессирования составляет 7,6 месяца. Затем назначают блокаторы PD-(L)1, такие как «Китруда» (Keytruda, пембролизумаб), «Опдиво» (Opdivo, ниволумаб), «Тецентрик» (Tecentriq, атезолизумаб), «Имфинзи» (Imfinzi, дурвалумаб), «Бавенсио» (Bavencio, авелумаб), — на них реагируют 15–20% пациентов. Если после всех указанных интервенций уротелиальная карцинома продолжает прогрессировать, иных вариантов лечения, кроме как повторной химиотерапии, эффективность которой посредственна, не существует.
- В апреле 2019 года «Джонсон энд Джонсон» (Johnson & Johnson) выпустила «Балверса» (Balversa, эрдафитиниб) — первый таргетный препарат для лечения взрослых пациентов с местнораспространенной или метастатической уротелиальной карциномой, которая характеризуется чувствительными к лекарственному соединению генетическими альтерациями FGFR3 или FGFR2 и которая прогрессирует во время или после хотя бы одного курса платиносодержащей химиотерапии, в том числе в течение 12 месяцев после неоадъювантной или адъювантной.
Подробности
Регуляторный вердикт вынесен по результатам первой когорты опорных клинических исследований EV-201 (NCT03219333) фазы II (нерандомизированных, открытых, многоцентровых, международных) среди взрослых пациентов (n=125) с местнораспространенной или метастатической уротелиальной карциномой (рак мочевого пузыря, почечной лоханки, мочеточника или уретры), ранее получавших блокаторы PD-(L)1 и платиносодержащие химиопрепараты.
Исходные характеристики пациентов следующие:
- медиана возраста — 69 лет (40–84), 70% мужчин;
- у 90% обнаружены висцеральные метастазы, включая 40% с печеночным метастазированием;
- у двух третей — переходно-клеточная опухолевая гистология;
- экспрессия нектина-4 выявлена у всех прошедших соответствующее тестированием;
- медианное число предшествовавших курсов системной терапии — 3 (1–6):
- 46% получали ингибитор PD-1, 42% — ингибитор PD-L1, 13% — оба;
- 66% назначали химиотерапию на основе цисплатина, 26% — карбоплатина, 8% — обоих.
В ходе наблюдений в течение медианных 10,2 месяца назначение «Падсева» обеспечило следующие клинические исходы:
- частота общего ответа (ORR) вышла к 44% (n=55/125) [95% ДИ: 35,1–53,2], при этом полный ответ (CR) зафиксирован у 12% пациентов (n=15/125), частичный ответ (PR) — у 32% (n=40/125);
- медиана длительности ответа (DoR) составила 7,6 месяца (95% ДИ: 6,3 — NE);
- ответ на лечение отмечен во всех подгруппах — независимо от числа предшествовавших курсов лечения, реагирования на PD-(L)1-ингибиторы, наличия метастазов в печени, то есть даже среди пациентов с весьма плохим прогнозом:
- три и более линий предшествовавшей терапии: ORR 41% (n=26/63);
- невосприимчивость к блокаторам PD-(L)1: ORR 41% (n=41/100);
- метастазы в печени: ORR 38% (n=19/50).
- медиана общей выживаемости (OS) достигла 11,7 месяца (95% ДИ: 9,1 — NE);
- медиана выживаемости без прогрессирования (PFS) зафиксировалась на уровне 5,8 месяца (95% ДИ: 4,9–7,5).
Среди наиболее распространенных побочных реакций на применение энфортумаба ведотина: усталость (50% пациентов), алопеция (49%), снижение аппетита (44%), нарушение вкусовых ощущений (40%), периферическая сенсорная нейропатия (40%), тошнота (39%), диарея (32%), макулопапулезная сыпь (22%), снижение веса (22%), сухость кожи (22%).
Для пущего понимания эффективности «Падсева»: в клинических испытаниях KEYNOTE-045 (NCT02256436) и IMvigor211 (NCT02302807) фазы III среди пациентов с местнораспространенной или метастатической уротелиальной карциномой, уже прошедших платиносодержащую химиотерапию, применение антимикротубулиновых агентов (паклитаксела, доцетаксела или винфлунина) в контрольных группах вывело ORR к диапазону 11–13%, включая CR 3%. При этом в этих исследованиях участники не получали блокаторы PD-(L)1, то есть больные, которым назначали энфортумаб ведотин, характеризовались куда большей запущенностью заболевания.
В клинических испытаниях RANGE (NCT02426125) фазы III при таком же онкопоказании контрольная группа пациентов, ранее получавших платиносодержащие химиопрепараты и блокаторы PD-(L1), назначение доцетаксела определило ORR на уровне 10,5%.
И хотя несравнительная природа клинических испытаний EV-201 не дает возможностей для прямого сравнения активности энфортумаба ведотина и стандартной антимикротубулиновой химиотерапии, существенные различия по показателя ORR (44%) и CR (12%), позволяет смело полагать, что «Падсев» уверенно обходит существующие схемы лечения. Монотерапия энфортумабом ведотином обеспечила ORR на уровне, схожем с таковым для гемцитабина и карбоплатина при их первоочередном применении, что свидетельствует о необходимости проверки «Падсева» на более ранних этапах терапии уротелиальной карциномы.
Так и порешили: «Астеллас» и «Сиэтл джинетикс» договорились с «Мерк и Ко» (Merck & Co.) о проведении опорных клинических испытаний фазы III, которые проверят комбинацию из энфортумаба ведотина и «Китруды» (Keytruda, пембролизумаб), блокатора PD-1, в задаче первоочередного лечения местнораспространенной или метастатической уротелиальной карциномы. Обнадеживающие результаты уже получены: в клинических исследованиях EV-103 (NCT03288545) фазы I указанное сочетание отметилось показателем ORR на весьма высоком уровне — 71%, причем без привязки к статусу опухолевой экспрессии PD-L1.
Энфортумаб ведотин (enfortumab vedotin, ASG-22ME) — конъюгат человеческого моноклонального антитела AGS-22 против нектина-4 (nectin-4), несущий цитотоксический монометилауристатин E (MMAE). Лекарственное соединение избирательно связывается с нектином-4 — иммуноглобулиноподобной молекулой клеточной адгезии и опухолеассоциированным антигеном, также известным как белок 4, связанный с рецептором полиовируса (PVRL4, PRR4), который сверхэкспрессирует на поверхности злокачественных клеток при различных солидных опухолях, включая рак мочевого пузыря (в 97% случаев), молочной железы, легких, поджелудочной железы. После интернализации энфортумаба ведотина и протеолитического расщепления линкера происходит связывание MMAE с тубулином, что ингибирует полимеризацию последнего. Это приводит к остановке фазы G2/M клеточного цикла и индуцированию апоптоза опухолевых клеток, сверхэкспрессирующих нектин-4.

С учетом того, что клиническая значимость нектина-4 была установлена не далее как пять лет назад, усилия «Сиэтл джинетикс» достойны восхищения.
Появление «Падсева» наконец-то избавило «Сиэтл джинетикс» от статуса фармкомпании одного препарата: она продвигала единственный коммерциализированный актив в лице «Адцетриса» (Adcetris, брентуксимаб ведотин) — конъюгата моноклонального антитела против CD30 для терапии классической лимфомы Ходжкина и неходжкинских лимфом.
Научный эксперт R&A-офиса Mosmedpreparaty.ru.
Дополнительная информация о Татьяне и ее контактные данные доступны в разделе «Научно-исследовательский офис».
Навигация по записям
Источник
«Балверса»: первая таргетная терапия метастатического рака мочевого пузыря
«Балверса» (Balversa, эрдафитиниб) — первый таргетный препарат для лечения взрослых пациентов с местнораспространенной или метастатической уротелиальной карциномой, которая характеризуется чувствительными к лекарственному соединению генетическими альтерациями FGFR3 или FGFR2 и которая прогрессирует во время или после хотя бы одного курса платиносодержащей химиотерапии, в том числе в течение 12 месяцев после неоадъювантной или адъювантной.
Коротко
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило «Балверса» (Balversa, эрдафитиниб) — первый таргетный препарат для лечения взрослых пациентов с местнораспространенной или метастатической уротелиальной карциномой, которая характеризуется чувствительными к лекарственному соединению генетическими альтерациями FGFR3 или FGFR2 и которая прогрессирует во время или после хотя бы одного курса платиносодержащей химиотерапии, в том числе в течение 12 месяцев после неоадъювантной или адъювантной. Вердикт регулятора вынесен в условном порядке, то есть «Балверсе», за которым стоит «Янссен» (Janssen), принадлежащая «Джонсон энд Джонсон» (Johnson & Johnson), еще предстоит подтвердить собственную эффективность.
- В настоящее время алгоритм лечения уротелиальной карциномы (в основном это рак мочевого пузыря) предполагает назначение платиносодержащей химиотерапии (или агрессивной химиотерапии без препаратов на основе платины) и блокаторов PD-(L)1. Если ничего не получилось, вариантов не так много: дальнейшая химиотерапия, участие в клинических испытаниях, симптоматическая терапия.
- Эрдафитиниб (erdafitinib) — пероральный низкомолекулярный ингибитор ферментативной активности рецепторов 1, 2, 3 и 4 фактора роста фибробластов (FGFR1, FGFR2, FGFR3 и FGFR4). Генетические альтерации последних связаны с усиленным опухолевым ростом, метастазированием, ангиогенезом и сниженной выживаемостью пациентов. Эрдафитиниб подавляет фосфорилирование и сигнальную активность FGFR, ослабляет жизнеспособность клеточных линий, экспрессирующих генетически измененные FGFR, включая их точечные мутации, амплификации и слияния. Эрдафитиниб также ингибирует RET, CSF1R, PDGFRA, PDGFRB, FLT4, KIT и VEGFR2.
Подробности
Клинические исследования BLC2001 (NCT02365597) фазы II (нерандомизированные, открытые, многоцентровые) вовлекли пациентов с местнораспространенной или метастатической уротелиальной карциномой. Безопасность и эффективность эрдафитиниба были изучены в когорте больных (n=87), заболевание которых прогрессировало во время или после хотя бы одного курса химиотерапии и которое характеризовалось наличием следующих генетических альтераций: мутации гена FGFR3 (R248C, S249C, G370C, Y373C) или слияния генов FGFR (FGFR3-TACC3, FGFR3-BAIAP2L1, FGFR2-BICC1, FGFR2-CASP7).
Моноприменение эрдафитиниба обеспечило частоту общего ответа (ORR) на уровне 32,2%, включая полный ответ (CR) у 2,3% участников и частичный ответ (PR) у 29,9%. Что важно, ответ также получен у пациентов, которые ранее проходили терапию блокаторами PD-1/PD-L1. Медиана длительности ответа (DoR) составила 5,4 месяца.
Предварительные результаты говорят об общей выживаемости (OS) в пределах 13,8 месяца.
Среди серьезных побочных реакций на назначение «Балверсы»: центральная серозная ретинопатия и отслойка пигментного эпителия сетчатки, гиперфосфатемия, эмбриофетальная токсичность.
Да, «Балверса» подходит не всем пациентам (FGFR-альтерации встречаются в 20% случаев рецидивирующего или рефрактерного заболевания), но начало таргетному лечению запущенного рака мочевого пузыря положено. Вообще уротелиальная карцинома по-прежнему нуждается в таргетных препаратах. Молекулярное профилирование выявило генетические и эпигенетические альтерации, затрагивающие не менее чем три десятка генов, включая рецепторные тирозинкиназы RAS/RAF, PI3K, AKT и сигнальный путь mTOR, регуляторы прохождения по клеточному циклу TP53 и RB1, мутации и транслокации FGFR3, делеции PTEN, амплификации FGFR1, CCND1 и MDM2, аберрации генов ремоделирования хроматина UTX, MLL-MLL3, CREBBP-EP300, NCOR1, ARID1A, CHD6.
Параллельно эрдафитиниб проверяется в терапии множества иных онкологических заболеваний с FGFR-аберрациями: холангиокарциномы, гепатоцеллюлярной карциномы, множественной миеломы, немелкоклеточного рака легких, рака пищевода, рака молочной железы.
Появление эрдафитиниба, разработанного «Астекс фармасьютикалс» (Astex Pharmaceuticals), укладывается в планы «Джонсон энд Джонсон» на вывод в свет десятка потенциальных бестселлеров.
FGFR-ингибиторами занимаются и другие отраслевые игроки: к примеру, низкомолекулярные инфигратиниб (infigratinib), пемигатиниб (pemigatinib), сульфатиниб (sulfatinib), луцитиниб (lucitinib), деразантиниб (derazantinib), роблитиниб (roblitinib) и моноклональное антитело вофатамаб (vofatamab) — их разрабатывают соответственно «Бриджбайо» (BridgeBio), «Инсайт» (Incyte), «Хатчисон Чайна Медитек» (Hutchison China MediTech), «Кловис онколоджи» (Clovis Oncology), «Аркьюл» (ArQule), «Эверест медисинс» (Everest Medicines) и «Рейнир терапьютикс» (Rainier Therapeutics), а их селективность отличается. Следует понимать, что к FGFR-таргетной терапии вполне может развиваться резистентность: опухоли находят другие пути, подпитывающие их рост.
САМЫЕ АКТУАЛЬНЫЕ И ВАЖНЫЕ НОВОСТИ ГЛОБАЛЬНОЙ ОТРАСЛИ ФАРМАЦИИ, БИОТЕХНОЛОГИЙ, МЕДИЦИНЫ И ЗДРАВООХРАНЕНИЯ — НА САЙТЕ MOSMEDPREPARATY.RU
Mosmedpreparaty.ru — специализированная научно-исследовательская и справочно-информационная аналитическая служба группы компаний «Мосмедпрепараты», таргетированная на ключевые события глобальной отрасли фармации, биотехнологий, медицины и здравоохранения. Ничто на Mosmedpreparaty.ru не является рекламой лекарственных препаратов или медицинских услуг. Ничто на Mosmedpreparaty.ru не может служить единственным руководством к действию. Сведения и публикации Mosmedpreparaty.ru носят исключительно научно-информационный характер. Информация, транслируемая Mosmedpreparaty.ru, предназначена только для специалистов в области здравоохранения и сфере обращения лекарственных средств и не может быть использована пациентами самостоятельно при принятии решений о применении лекарственных препаратов и методов лечения.
Источник
Лечение рака мочевого пузыря: симптомы и диагностика опухоли мочевого пузыря в Европейской клинике
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последнего поколения с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название — переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа — уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1–2% случаев (по данным Американского онкологического сообщества — American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев — аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев — мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы — злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N — наличие очагов поражения в регионарных лимфоузлах, M — наличие отдаленных метастазов в других органах.

В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 — неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии — это инвазивный рак.
- Стадия I — опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II — опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III — злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1—3), отдаленных метастазов нет (M0).
- Стадия IV — злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
Важно внимательно относиться к своему здоровью, обращать внимание на любые симптомы, которые сохраняются в течение длительного времени, и при их возникновении сразу обращаться к врачу.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
- Цитологическое исследование мочи — её изучение под микроскопом на предмет наличия опухолевых клеток. Этот анализ иногда помогает диагностировать рак на ранних стадиях, но он не идеален.
- Исследование мочи на онкомаркеры — вещества, повышение уровней которых может свидетельствовать о злокачественной опухоли. Это также не совсем надежный тест.
- Цистоскопия — эндоскопическое исследование мочевого пузыря, когда в орган вводят специальный инструмент — цистоскоп — с видеокамерой. Наиболее информативна так называемая цистоскопия с синим светом. В мочевой пузырь вводят специальный препарат, который накапливается в опухолевых клетках и заставляет их флуоресцировать («светиться») в лучах синего света.
- Биопсия — исследование, во время которого получают фрагмент патологически измененной ткани и изучают в лаборатории под микроскопом. Это самый надежный способ разобраться, присутствуют ли в патологическом образовании раковые клетки, и является ли оно злокачественным. Материал для биопсии можно получить во время цистоскопии.
- Внутривенная пиелография. Пациенту внутривенно вводят раствор рентгеноконтрастного препарата, который затем начинает выводиться почками и «прокрашивает» мочевыводящие пути на рентгеновских снимках. Это помогает обнаружить опухоли.
- Ретроградная пиелография — исследование, во время которого рентгеноконтрастный раствор вводят через катетер, установленный в мочевом пузыре или мочеточнике.
- Ультразвуковое исследование помогает оценить размеры опухоли, выяснить, не распространилась ли она за пределы мочевого пузыря, проверить состояние почек. Под контролем УЗИ в обнаруженную опухоль можно ввести иглу и провести биопсию.
- Компьютерная томография и МРТ помогают оценить размеры, расположение, количество опухолевых очагов, обнаружить распространение рака на соседние органы, в лимфатические узлы, выявить метастазы. Под контролем КТ также можно провести биопсию с помощью иглы.
- Рентгенографию применяют для поиска метастазов в легких, костях.
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Как выбирают лечение при раке мочевого пузыря?
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
Хирургическое лечение
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент — резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
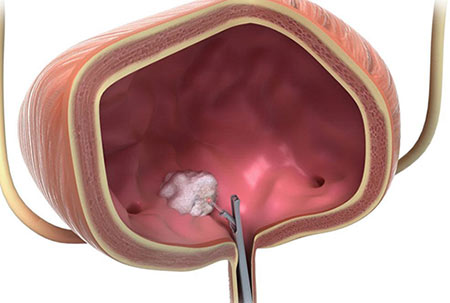
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию — удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.
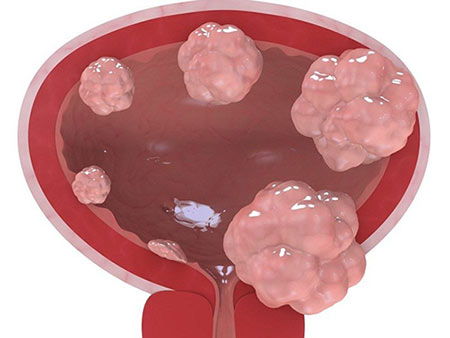
Большинству больных приходится выполнять цистэктомию — полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин — семенные пузырьки и простату, у женщин — матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения — когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция — когда хирург подсоединяет к одному концу кишки мочеточники, а к другому — мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиотерапия
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
- Неоадъювантную химиотерапию проводят до хирургического вмешательства. Благодаря препаратам опухоль уменьшается, и ее становится проще удалить.
- Адъювантная химиотерапия применяется после операции. Если в организме пациента остались раковые клетки, химиопрепараты их уничтожают, за счет этого снижается риск рецидива.
- Химиолучевая терапия — когда химиопрепараты назначают «в помощь» лучевой терапии. За счет этого повышается эффективность лечения рака.
- Паллиативная химиотерапия — один из основных методов лечения на поздних стадиях, когда опухоль неоперабельна, имеются отдаленные метастазы. Химиопрепараты помогают продлить жизнь пациента и избавить от некоторых симптомов.
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.
Лучевая терапия
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Иммунотерапия рака мочевого пузыря
Иммунитет человека умеет уничтожать не только болезнетворные микроорганизмы, проникшие извне, но и собственные клетки, в генах которых возникли «ошибки». Именно из-за таких «ошибок» нормальная клетка превращается в раковую. Однако, опухолевые клетки умеют «обманывать» иммунитет, и используют для этого сложные молекулярные механизмы.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2–3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10–15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса — для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухоли, состояния здоровья пациента, наличия и отсутствия у него противопоказаний.
Оптимальные методы лечения злокачественных опухолей мочевого пузыря прописаны в специальных документах — протоколах. Они составлены на основе результатов многочисленных клинических исследований с участием тысяч пациентов по всему миру и регулярно пересматриваются, обновляются.
Врачи в Европейской клинике руководствуются последними версиями американских, европейских, израильских протоколов лечения.
Насколько эффективны современные методы лечения, каков прогноз?
В среднем в течение 5 лет остаются в живых 77% пациентов, в течение 10 лет — 70%, в течение 15 лет — 65%. Пятилетняя выживаемость при злокачественных опухолях мочевого пузыря зависит от стадии:
- Стадия 0–98%.
- Стадия I—88%.
- Стадия II—63%.
- Стадия III—46%.
- Стадия IV—15%.
В настоящее время проводятся клинические исследования, врачи ищут более эффективные способы борьбы с заболеванием, а значит, есть надежда, что в ближайшем будущем эти показатели улучшатся.
Источник