Рецепторы шейки мочевого пузыря
Содержание статьи
Нижние мочевые пути
Анатомия
Нижние мочевые пути представлены мочевым пузырем, уретрой, внутренним и наружным сфинктерами, шейкой мочевого пузыря с важной анатомической структурой внутренним отверстием уретры, поперечно-полосатой мускулатуры тазового дна. Мышцы тазового дна одинаковы у мужчин и женщин, однако у мужчин шейка мочевого пузыря более выражена, а простата и наружный рабдосфинктер способствуют дополнительной поддержке шейки мочевого пузыря. У женщин леваторная мускулатура и наружный сфинктер являются основными поддерживающими структурами для мочевого пузыря. Стенка мочевого пузыря представлена связанными между собой пучками гладкомышечных волокон, которые образуют так называемый детрузор. Между пучками гладкой мускулатуры находится соединительная ткань, которая обеспечивает мочевому пузырю функцию эластичности. Внутренний сфинктер уретры представлен мышечными пучками шейки и проксимальной уретры. Вокруг уретры и внутреннего сфинктера расположены волокна поперечно-полосатой мускулатуры (периуретральная полосатая мускулатура), которые входят в состав тазового дна и образуют наружный сфинктер.
Иннервация
Иннервация нижних мочевых путей обеспечивается афферентной и эфферентной дугой периферической нервной системы, в которую входят симпатические, парасимпатические и соматические нейроны. Эфферентные нервы содержат только миелинизированные волокна. Афферентные проводящие нервные пути представлены как миелинизированными А-δ волокнами и немиелинизированными С-волокнами. В норме рефлекс мочеиспускания инициируется возбуждением А-δ волокон. С-афферентные волокна не являются основными для осуществления произвольного мочеиспускания.
Симпатические нервные волокна начинаются в боковых рогах на уровне T1-L2 сегментов позвоночника. В фазу накопления симпатическая нервная система обеспечивает закрытие сфинктеров и релаксацию детрузора. И наоборот парасимпатическая нервная система ответственна за сокращение детрузора и одновременное расслабление сфинктеров во время мочеиспускания. Нервные волокна парасимпатической нервной системы берут свое начало из ІІ, ІІІ, ІV сегментов сакрального отдела позвоночника.
Соматические эфферентные мотонейроны происходят из ІІ, ІІІ, ІV сегментов сакрального отдела позвоночника. Соматическая иннервация поддерживает тонус тазовой мускулатуры и сокращение наружного сфинктера. Функция мочевого пузыря регулируется вышележащими отделами нервной системы, включая стволовые структуры головного мозга и кору. Кора головного мозга оказывает в основном тормозящее действие на нижние мочевые пути, а ствол мозга напротив способствует началу мочеиспускания.
Запишитесь на прием к урологу по телефону 8(812)952-99-95 или заполнив форму online — администратор свяжется с Вами для подтверждения записи
Центр «Уроклиник» гарантирует полную конфиденциальность
Нейромедиаторы
Ацетилхолин активирует мускариновые рецепторы, что вызывает сокращение детрузора и это наиболее важный физиологический механизм, обеспечивающий опорожнение мочевого пузыря. Мускариновые рецепторы, расположенные на пресинаптических нервных терминалях могут возбуждаться или подавляться. К настоящему времени в мочевом пузыре человека идентифицированы 3 подтипа мускариновых рецепторов (М1 — М3). Рецепторы подтипа М1 способствуют высвобождению ацетилхолина. Несмотря на то, что М2 рецепторы преобладают в мочевом пузыре именно М3 рецепторы обеспечивают холинергически индуцированное сокращение детрузора. М2 и М3 рецепторы функционально связаны между собой и действуют синергично. Поэтому активация М2 рецепторов подавляет влияние симпатической нервной системы (релаксация детрузора) и усиливает детрузорное сокращение при возбуждении М3 рецепторов. Существуют также доказательства того, что М2 рецепторы могут в некоторой степени непосредственно стимулировать сокращения мочевого пузыря. Плотность мускариновых рецепторов в мочевом пузыре может изменяться в связи с возрастом, неврологическими нарушениями и заболеваниями. Это может способствовать развитию гиперактивности мочевого пузыря.
Нормальная функция мочевого пузыря
Функция мочевого пузыря заключается в накоплении и удержании мочи в течение фазы наполнение и её изгнании во время фазы опорожнения.
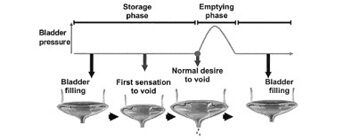
Фаза накопления/удержания
За сутки почки образуют приблизительно 1-2 литра мочи. Регулярные перистальтические сокращения мочеточников приводят к поступлению мочи в мочевой пузырь. Заполнение мочевого пузыря и необходимость её удержания обеспечивается аккомодационными свойствами мочевого пузыря, которые заключаются в поддержании низкого внутрипузырного давления, несмотря на увеличивающийся объём мочи, нормальной чувствительностью, закрытием сфинктеров в покое и при эпизодах повышения внутрибрюшного давления, отсутствием непроизвольных детрузорных сокращений.
Нормально функционирующий детрузор позволяет наполняться мочевому пузырю с отсутствием или незначительным повышением внутрипузырного давления. При пустом мочевом пузыре стенка образует множественные складки. Вискоэластические свойства стенки мочевого пузыря объясняют поддержание низкого и относительно постоянного внутрипузырного давления при увеличение его внутреннего объёма. При наполнении гладкомышечные волокна детрузора удлиняются, что позволяет растягиваться мочевому пузырю. В ответ чувствительным к растяжению уротелием непрерывно высвобождаются медиаторы, стимулирующие А-δ волокна. Симпатические нервы активируются и подавляют парасимпатическое влияние на стенку мочевого пузыря, что приводит к торможению непроизвольных сокращений детрузора. Одновременно стимулируются внутренний и наружный сфинктер, которые поддерживают достаточное для удержания мочи уретральное сопротивление. Соматическая нервная система стимулирует наружный сфинктер и полосатую мускулатуру тазового дна, что также подавляет парасимпатическое влияние на детрузор. Таким образом, в фазу накопления, проводящие нервные пути, стимулирующие мочеиспускание остаются неактивными, а тормозящие сокращение детрузора активны.
Фаза опорожнения
Нормальная функция мочевого пузыря в фазу опорожнения подразумевает афферентные импульсы, свидетельствующие о том, что мочевой пузырь полный скоординированные сокращения гладкой мускулатуры детрузора достаточной силы, незначительное сопротивление току мочи на уровне внутреннего и наружного сфинктера и отсутствие анатомической инфравезикальной обструкции.
Во время фазы наполнения афферентные проводящие пути тазового нерва «посылают» информацию о степени наполнения мочевого пузыря в центр мочеиспускания через периакведуальную область серого вещества головного мозга. По мере наполнения мочевого пузыря сокращение наружного уретрального сфинктера усиливается, уретральное сопротивление возрастает с увеличение внутриуретрального давления. По достижении мочевым пузырем порога критического объёма афферентная составляющая тазового нерва инициирует рефлекс мочеиспускания. Когда объём мочи в мочевом пузыря достигает приблизительно половины его физиологической ёмкости центр мочеиспускания головного мозга интегрирует эту сенсорную информацию и индивидуальное чувство «полного» мочевого пузыря. При достижении объёма мочи приблизительно 75% ёмкости мочевого пузыря возникает позыв опорожнить мочевой пузырь.
Рефлекс мочеиспускания (опорожнения мочевого пузыря) находится под произвольным супраспинальным контролем. Нормальное опорожнение мочевого пузыря есть координированное сокращение детрузора и снижение уретрального сопротивления за счет открытия сфинктеров и шейки мочевого пузыря. Центр мочеиспускания тормозит активность симпатических и соматических ганглиев спинного мозга и стимулирует активность парасимпатических отделов периферической нервной системы в основном через ацетилхолиновое возбуждение М3 рецепторов. Одновременно подавляется симпатическая стимуляция гладкой мускулатуры уретры и соматическая стимуляция полосатой мускулатуры наружного сфинктера и тазового дна. Это приводит к повышению внутрипузырного и снижению внутриуретрального давления и в конечном итоге опорожнению мочевого пузыря. Таким образом, мочеиспускание является неврологически обусловленным произвольным актом с координированным взаимодействием между головным и спинным мозгом, мочевым пузырем и уретрой и тазовой мускулатурой с чередованием фаз накопления и опорожнения мочи.
Источник
Нейрональный контроль мочеиспускания. Часть 1.
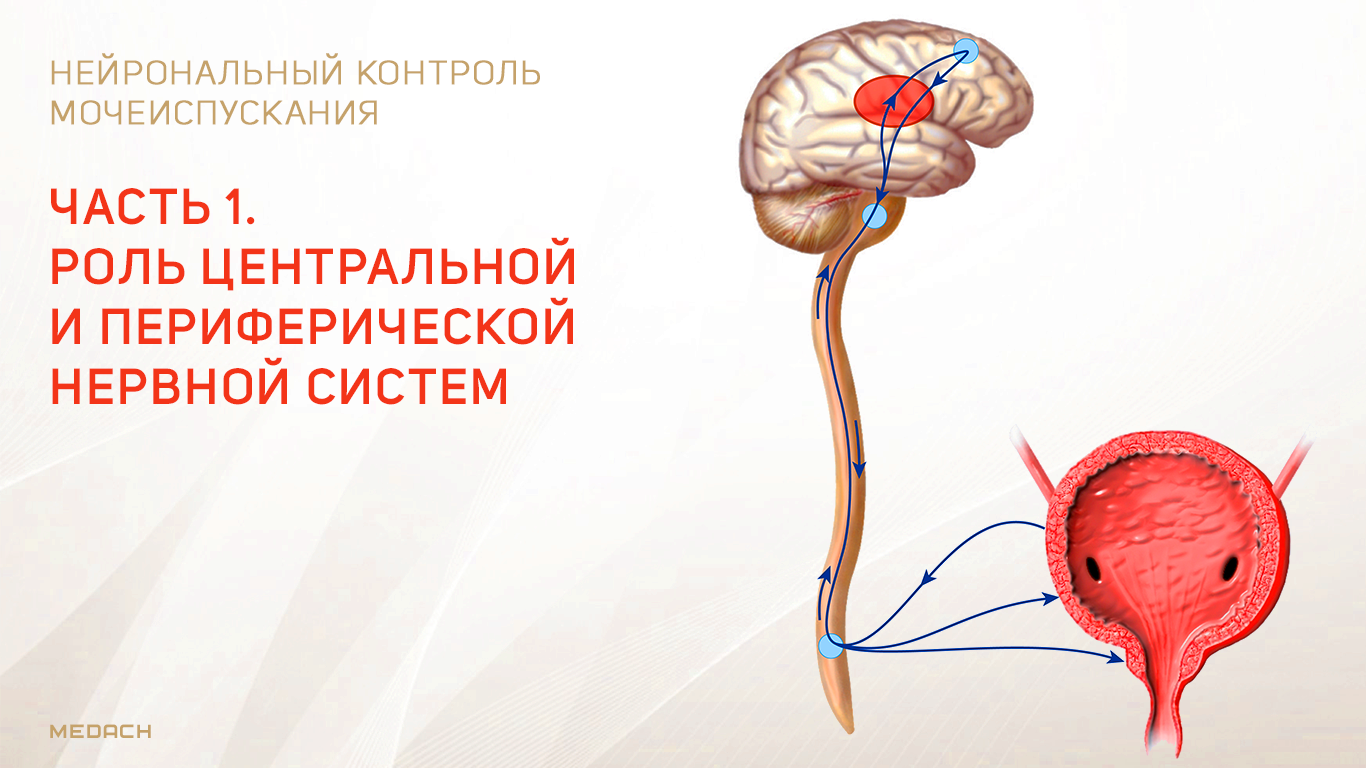
Хранение мочи и периодическое опорожнение мочевого пузыря (МП) зависят от координированной работы гладких и поперечнополосатых мышц, условно разделенных на два структурно функциональных отдела: резервуара (мочевой пузырь) и выпускной системы, состоящей из шейки МП, уретры и наружного сфинктера мочеиспускательного канала. За координированную работу вышеперечисленных структур отвечают сложные нейронные системы управления, расположенные в периферических ганглиях, спинном и головном мозге.
Обеспечение сознательного контроля мочеиспускания требует сложных взаимодействий между вегетативным (симпатика и парасимпатика) и соматическим отделами нервной системы.
Симпатические нервные волокна берут свое начало из боковых рогов грудопоясничного отдела (спинномозговой центр Якобсона) и ганглиях нижнего брыжеечного сплетения и достигают МП в составе подчревного нерва. Симпатические постганглионарные нервы выделяют норадреналин, который активирует β-адренергические рецепторы, ингибирующие сокращение детрузорной мышцы, и α-адренергические рецепторы, возбуждающие мускулатуру уретры и шейки МП. Симпатическое воздействие приводит к расслаблению мышцы, изгоняющей мочу, сокращению мускулатуры уретры и шейки МП и ингибированию интрамуральных ганглиев МП.
Центральный отдел парасимпатической иннервации МП располагается в промежуточных ядрах крестцовых сегментов. Холинергические преганглионарные волокна из промежуточных ядер посылают свои аксоны через тазовые нервы к ганглиозным клеткам тазового сплетения и интрамуральным нейронам в стенке мочевого пузыря. Ганглиозные клетки в свою очередь возбуждают детрузор мочевого пузыря, что приводит к его сокращению с последующим опорожнением. Основными медиаторами парасимпатической нервной системы тут являются ацетилхолин и другие нехолинергические медиаторы. Ацетилхолин действует опосредованно, возбуждая M3-холинорецепторы клеток детрузора. Парасимпатические нервные окончания в нервно-мышечных синапсах и в парасимпатических ганглиях тоже имеют холинорецепторы, возбуждение этих рецепторов на нервных окончаниях может усиливать (через рецепторы М1) или подавлять (через рецепторы М4) высвобождение медиаторов в зависимости от интенсивности нейронного возбуждения. Основной нехолинергический медиатор это АТФ, который активирует внутриклеточную пуринергическую систему через возбуждение P2X рецепторов и тоже способствует сокращению детрузора. Парасимпатические волокна вызывают расслабление ГМК уретры путем высвобождения оксида азота (NO).
Аксоны соматических двигательных нейронов передних рогов крестцовых сегментов S2-S4 (ядро Онуфа) проходят в срамном нерве и иннервируют поперечно-полосатые мышцы наружного уретрального сфинктера. Нейроны более медиально расположенного моторного ядра на том же уровне позвоночника иннервируют мускулатуру тазового дна.
Афферентные пути НМП состоят из цепочек чувствительных нейронов. Первые нейроны, располагающиеся в спинальных ганглиях на уровне S2-S4 и T11-L2, реагируют на пассивное растяжение и активное сокращение мышц МП и передают эту информацию на нейроны второго и третьего порядка. Эти нейроны обеспечивают координированную работу спинальных рефлексов и восходят к вышележащим структурам головного мозга, контролирующих фазы накопления и опорожнения МП. Наиболее важные афферентные волокна от мочевого пузыря идут в составе тазового нерва, в то время как чувствительность от шейки МП и уретры передается по срамным и подчревным нервам. Афферентные волокна этих нервов состоят из миелинизированных (Аδ) и немиелинизированных (С) аксонов. Aδ-волокна передают информацию о наполнении мочевого пузыря. С-волокна нечувствительны к изменению объема мочевого пузыря в физиологических условиях, поэтому они называются «тихими». Они реагируют главным образом на патологические стимулы, такие как химическое раздражение или охлаждение.
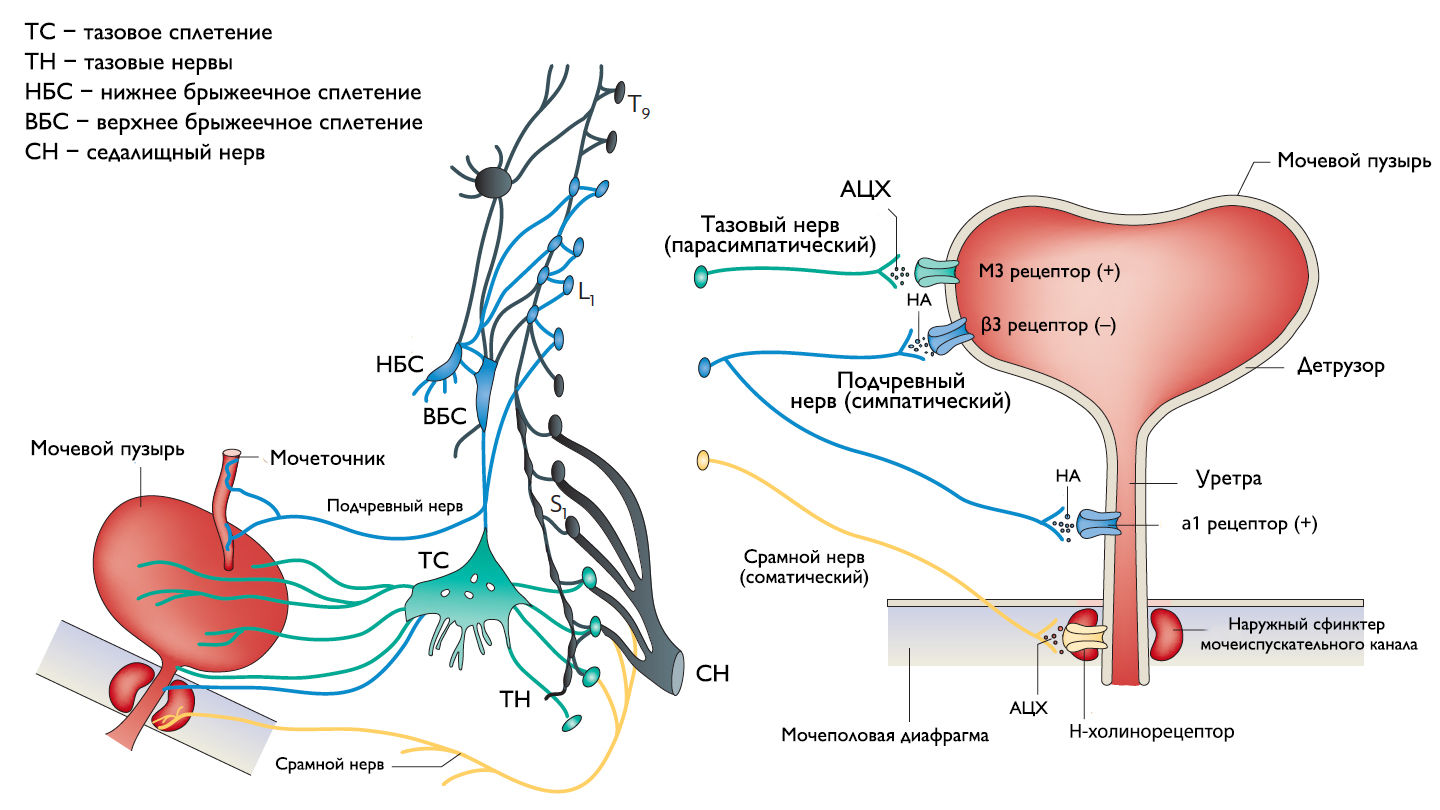
Рисунок 1 | Иннервация нижних мочевыводящих путей.
Специфический и неспецифический восходящий супраспинальный сенсорный путь
Одни спинномозговые промежуточные нейроны посылают восходящие волокна к определенным областям моста и среднего мозга, участвующим в мочеиспускании. Другие промежуточные нейроны передают информацию из нижних мочевыводящих путей в структуры переднего мозга, включая таламус и гипоталамус. Спиноталамический и спиногипоталамический тракты хотя и не играют главную роль в мочеиспускании, но могут включаться в сознательный контроль полноты мочевого пузыря. Чувствительные зоны коры ГМ через спиноталамический тракт информируются о состоянии наполнения МП.
Мостовой центр мочеиспускания (МЦМ) и его нисходящие спинномозговые двигательные пути
Впервые центр управления мочеиспусканием был открыт в дорсальной части моста Баррингтоном в 1925 году и с тех пор называется мостовым центром мочеиспускания или ядром Баррингтона. МЦМ располагается в области покрышки моста. Нейроны МЦМ имеют нисходящие возбуждающие синаптические контакты с клетками парасимпатических преганглионарных мотонейронов, иннервирующих постганглионарные клетки мочевого пузыря. Электрическая и химическая стимуляция МЦМ у крыс и кошек инициирует сокращение мочевого пузыря и расслабляет сфинктер уретры имитируя нормальное мочеиспускание. Цикл рефлекса мочеиспускания состоит из трех фаз, контролируемых различными центральными механизмами: фаза реализации безопасной среды — для начала мочеиспускания человеку необходимо осознание, что окружающие обстановка комфортна; фаза релаксации наружного уретрального сфинктера; и фаза сокращения мышцы, выталкивающей мочу. Процесс нормального мочеиспускания невозможен без какой-либо из этих фаз. МЦМ является командным центром мочеиспускания, который контролирует последовательное переключение фазы расслабления наружного уретрального сфинктера на фазу сокращения детрузорной мышцы.
Мостовой центр удержания мочи (МЦУ) и его нисходящие спинномозговые двигательные пути
Его роль заключается в расслаблении детрузора и сокращении наружного уретрального сфинктера. МЦУ располагается вентролатеральней МЦМ. Синапсы волокон МЦУ возбуждают ядро Онуфа в крестцовых сегментах спинного мозга, повышая таким образом тонус наружного сфинктера уретры. Стимуляция области МЦУ останавливает мочеиспускание, возбуждает мышцы тазового дна и сокращает уретральный сфинктер. Наоборот, двусторонние поражения МЦУ вызывают недержание мочи, чрезмерную детрузорную активность, невозможность хранения мочи и снижение тонуса уретрального сфинктера. На сегодняшний день нет анатомических доказательств связи между МЦУ и МЦМ, и было высказано предположение, что эти центры функционально независимы.
Роль кортикальных областей
Наиболее частые симптомы поражения кортикальных областей ГМ это поллакиурия и ургентное недержание мочи. Поэтому Andrew и Nathan выдвинули гипотезу, что отсоединение лобной или передней поясной извилины от гипоталамуса приводит к непроизвольному началу мочеиспускания [3]. Действительно, префронтальная кора головного мозга человека и передняя поясная извилина активируются во время мочеиспускания [4].
Мозжечок и базальные ганглии
Существует ряд исследований о том, что мозжечок и базальные ганглии оказывают в основном ингибирующее действие на мочевой пузырь. Мозжечковая патология приводит к увеличению частоты мочеиспускания и ургентному недержанию мочи. Симптомы гиперактивного мочевого пузыря также встречаются при болезни Паркинсона. Поскольку нет прямых связей этих областей с МЦМ, ингибирующее влияние, вероятно, косвенное через структуры переднего и среднего мозга.
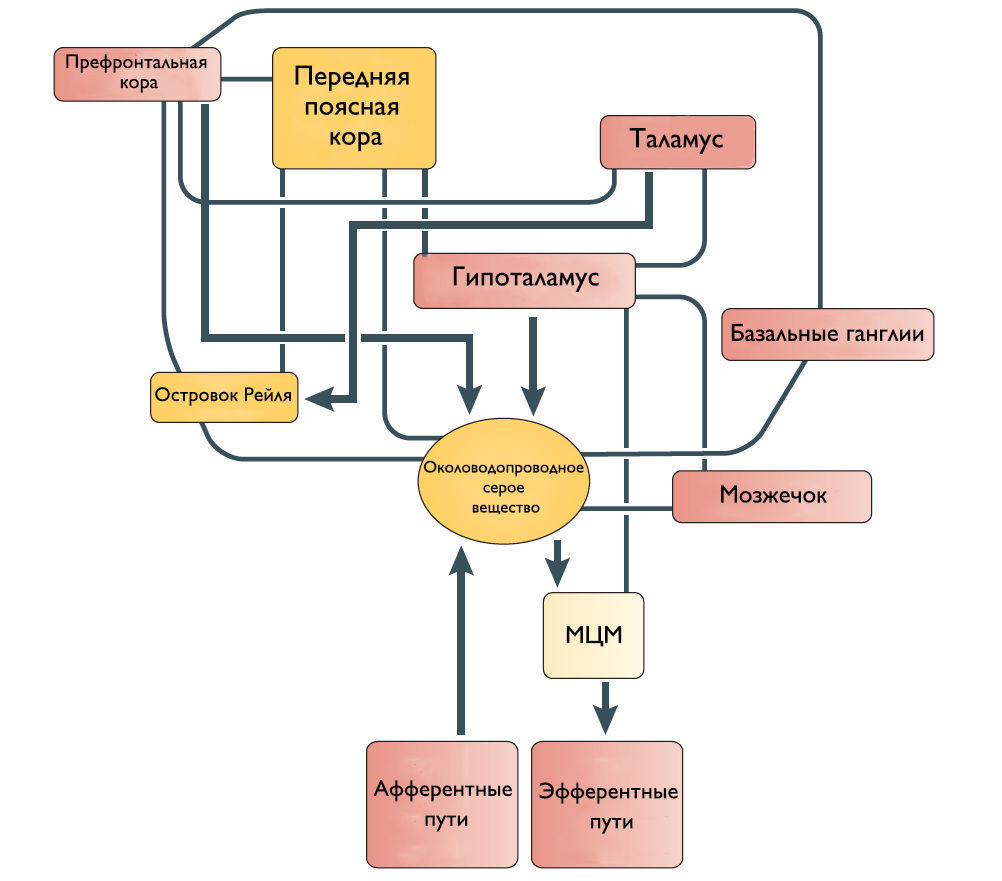
Рисунок 2 | Предположительное схематическое изображение связей между различными структурами переднего мозга и ствола мозга, которые участвуют в контроле мочеиспускания.
- Liao L., Madersbacher H. (ed.). Neurourology: Theory and Practice. — Springer, 2019.
- Clare J. Fowler et al. The neural control of micturition. — Nature Reviews | Neuroscience, volume 9. — June 2008.
- Andrew J, Nathan PW. Lesions of the anterior frontal lobes and disturbances of micturition and defecation. Brain. 1964;87:233-62.
- Griffiths, Derek J. «Use of al imaging to monitor central control of voiding in humans.» Urinary Tract. Springer, Berlin, Heidelberg, 2011. 81-97.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.

Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Proe Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5-2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3-8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
Источник