Псевдомембранозный энтероколит может стать причиной лихорадки
Содержание статьи
Псевдомембранозный энтероколит
Псевдомембранозный колит — заболевание толстого кишечника, характеризующееся воспалением и повышенным образованием бело-жёлтых бляшек, в совокупности представляющих из себя псевдомембрану на поверхности слизистой оболочки кишечника[1]. Как правило вызывается спорообразующей анаэробной бактерией Clostridium difficile, однако может возникать и по другим причинам[2]. Несмотря на то что клинические проявления болезни весьма вариабельны, чаще всего у больных наблюдаются длительная диарея, интоксикация, боль в животе и лейкоцитоз, возникающие, как правило, на фоне антибиотикотерапии.
Причины[править | править код]
Причиной псевдомембранозного энтероколита является нерациональное применение антибиотиков, приводящее к избыточному размножению определенного условно-патогенного микроба — Clostridium difficile.
Хотя этиологически Clostridium difficile является наиболее частой причиной заболевания, до эры антибиотиков заболевания часто ассоциировалось с ишемической болезнью, обструкцией, сепсисом, уремией и отравлением тяжёлыми металлами[2]. Помимо C. difficile из числа бактерий заболевание могут вызывать Clostridium ramosum, Escherichia coli O157:H7, Klebsiella oxytoca, Plesiomonas shigelloides, Salmonella enterica, шигеллы, золотистый стафилококк и Yersinia enterocolitica[3]. Из числа вирусных возбудителей заболевание может вызывать цитомегаловирус[3], однако у людей без нарушений работы иммунной системы колиты, вызванные цитомегаловирусом, встречаются редко[4]. Также заболевание могут вызывать несколько паразитов: дизентерийная амёба, Schistosoma mansoni (англ.)русск. и угрица кишечная[3]. В случае с Schistosoma mansoni (англ.)русск. под наибольшей угрозой находятся люди с нарушениями работы иммунной системы[5].
При ишемических колитах псевдомембранозный энтероколит часто приписывается C. difficile, в результате чего ишемический колит не всегда распознаётся на ранних стадиях заболевания, а диагностирование затруднено[6].
Симптомы и течение[править | править код]
Диарея, частый водянистый стул, со слизью и кровью. Повышается температура, появляются признаки интоксикации — слабость, разбитость, тошнота, рвота. Больной жалуется на боли в животе, которые усиливаются перед дефекацией, могут быть ложные позывы, тенезмы. При объективном исследовании живот умеренно вздут, отмечается болезненность при пальпации по ходу толстой кишки. Тяжелым можно считать такое течение заболевания, когда в клинике, наряду с выраженными кишечными проявлениями, наблюдаются сердечно-сосудистые нарушения — тахикардия, гипотония; явления дегидратации и электролитные расстройства. Часто бывают признаки нарушения белкового обмена, по-видимому, вследствие экссудативной энтеропатии. Утяжеляет состояние больного развитие осложнений — перфорации кишки и токсического мегаколон. У больного с перфорацией значительно усиливаются боли, появляется локальная болезненность и напряжение мышц брюшного пресса, определяется свободная жидкость в брюшной полости, ещё более усугубляются общие расстройства.
Лечение[править | править код]
Первым мероприятием является отмена антибиотика, спровоцировавшего развитие псевдомембранозного колита. Этиотропная терапия заключается в назначении антибактериальных средств, к которым чувствителен Сl.difficile. Это ванкомицин и метронидазол. Ванкомицин плохо всасывается в кишечнике, при пероральном приеме его концентрация быстро нарастает. Назначается по 125 мг 4 раза в день в течение 5-7 дней. Препаратом выбора является метронидазол (0,25 3 раза в день) в течение 7-10 дней. В тяжелых случаях, когда пероральный прием затруднен, метронидазол можно назначать внутривенно. Крайне важна патогенетическая терапия, особенно у больных тяжелыми формами заболевания. Основные её направления — коррекция водно-электролитных расстройств и белкового обмена, восстановление нормального состава кишечной микрофлоры, связывание токсина Cl.difficile. Прогноз всегда серьезный.
Было показано, что ректальное введение больным людям фекалий или микроорганизмов из фекалий, взятых от здоровых доноров, вылечивает системную инфекцию Clostridium difficile в 85-90% случаев[7][8][9].
В рандомизированных испытаниях безлотоксумаб, представляющий из себя моноклональные антитела, показал себя эффективным по сравнению с плацебо в предотвращении повторной инфекции C. difficile, снижая вероятность её появления[10].
Профилактика[править | править код]
Профилактика заболевания заключается в рациональном применении антибиотиков.
Примечания[править | править код]
- ↑ Farooq, Urrunaga, Tang, Rosenvinge, 2015, Abstract.
- ↑ 1 2 Farooq, Urrunaga, Tang, Rosenvinge, 2015, duction.
- ↑ 1 2 3 Farooq, Urrunaga, Tang, Rosenvinge, 2015, Table 1 Causes of pseudomembranous colitis.
- ↑ Farooq, Urrunaga, Tang, Rosenvinge, 2015, Viral infections, Cytomegalovirus colitis.
- ↑ Farooq, Urrunaga, Tang, Rosenvinge, 2015, Parasitic infections, Strongyloides stercoralis.
- ↑ Farooq, Urrunaga, Tang, Rosenvinge, 2015, Ischemic colitis, p. 12.
- ↑ Джонатан Эйзен. Знакомьтесь, ваши микробы. TED Talks (7 января 2012).
- ↑ Burke K.E., Lamont J.T. Fecal Transplantation for Recurrent Clostridium difficile Infection in Older Adults: A Review. (англ.) // Journal of the American Geriatrics Society (англ.)русск. : journal. — 2013. — August (vol. 61, no. 8). — P. 1394-1398. — doi:10.1111/jgs.12378. — PMID 23869970.
- ↑ Drekonja, D; Reich, J; Gezahegn, S; Greer, N; Shaukat, A; MacDonald, R; Rutks, I; Wilt, T.J. Fecal Microbiota Transplantation for Clostridium difficile Infection: A Systematic Review (англ.) // Annals of Internal Medicine (англ.)русск. : journal. — 2015. — 5 May (vol. 162, no. 9). — P. 630-638. — doi:10.7326/m14-2693. — PMID 25938992.
- ↑ Mark H. Wilcox, Dale N. Gerding, Ian R. Poxton, Ciaran Kelly, Richard Nathan. Bezlotoxumab for Prevention of Recurrent Clostridium difficile Infection (англ.) // New England Journal of Medicine. — 2017. — 26 January (vol. 376, iss. 4). — P. 305-317. — ISSN 0028-4793. — doi:10.1056/NEJMoa1602615. Архивировано 28 марта 2021 года.
Литература[править | править код]
- Priya D. Farooq, Nathalie H. Urrunaga, Derek M. Tang, Erik C. von Rosenvinge. Pseudomembranous Colitis : [англ.] // Disease-a-month : DM. — 2015. — Vol. 61, no. 5 (May). — P. 181-206. — ISSN 0011-5029. — doi:10.1016/j.disamonth.2015.01.006. — PMID 25769243. — PMC 4402243.
Ссылки[править | править код]
- Клостридиозный псевдомембранозный колит (Автор Масленникова Н. А.)
- Псевдомембранозный колит
- Гастроэндоскопия. Псевдомембранозный энтероколит
- Псевдомембранозный колит. Болезни на Йод. Ру
Источник
Псевдомембранозный колит
Псевдомембранозный колит — это острое воспаление толстого кишечника, вызываемое условно патогенными клостридиями и возникающее на фоне приема антибиотиков или (реже) других лекарственных средств. Клинические проявления могут варьировать. Обычно выявляются боли в животе и продолжительная диарея в сочетании с признаками общей интоксикации. В тяжелых случаях возможны грубые повреждения кишечной стенки, выраженные расстройства обмена и летальный исход. Заболевание диагностируется на основании симптомов, данных осмотра, анализов крови и кала, эндоскопического исследования. Лечение — отмена антибиотика, диета, этиотропная терапия, коррекция обменных нарушений.
Общие сведения
Псевдомембранозный колит — тяжелое осложнение приема антибиотиков, реже лечения препаратами других групп, в результате которого у больного развивается специфический дисбактериоз, сопровождающийся воспалением толстого кишечника с образованием характерных пленок на слизистой оболочке. Дисбактериоз и воспаление слизистой вызывают анаэробные грамположительные бактерии Clostridium difficile. В тяжелых случаях псевдомембранозный колит сопровождается выраженной интоксикацией, повреждениями стенки кишечника вплоть до перфорации, общей дегидратацией и грубыми электролитными расстройствами, нередко — в сочетании нарушениями белкового обмена. Возможен летальный исход. Лечение осуществляют специалисты в области клинической проктологии и гастроэнтерологии.
Псевдомембранозный колит
Причины
Причиной псевдомембранозного колита является нарушение нормальной кишечной микрофлоры, сопровождающееся избыточным размножением условно патогенной бактерии Clostridium difficile. В подавляющем большинстве случаев дисбактериоз, предшествующий развитию псевдомембранозного колита, возникает на фоне приема антибиотиков, однако в отдельных случаях состав микрофлоры кишечника может меняться под влиянием цитостатиков, иммуносупрессоров и слабительных средств.
Чаще всего псевдомембранозный колит вызывают такие антибиотики, как клиндамицин, амоксициллин, ампициллин, линкомицин и препараты из группы цефалоспоринов. Реже псевдомембранозный колит развивается при приеме левомицетина, эритромицина, тетрациклина и пенициллина. Из-за подавления микробов-симбионтов в кишечнике начинают размножаться Clostridium difficile. Эти бактерии в небольшом количестве содержатся в ЖКТ примерно у 3% населения.
Размножающиеся клостридии выделяют токсические вещества, оказывающие негативное влияние на слизистую оболочку кишечника и вызывающие развитие псевдомембранозного колита. Некоторые антибиотики усиливают повреждающее действие токсинов, что еще больше усугубляет возникшие нарушения. Стенка кишечника теряет свои барьерные свойства и начинает интенсивно секретировать жидкость в просвет кишки. Токсичные соединения всасываются в организм, вызывая развитие интоксикации. Жидкость перемещается в просвет кишечника, развивается обезвоживание, возникают электролитные расстройства.
В тяжелых случаях у больных псевдомембранозным колитом выявляются нарушения белкового обмена. Страдает сердечно-сосудистая система. Возможно формирование токсического мегаколона и прободение стенки кишечника с излитием кишечного содержимого в брюшную полость. Причиной летального исхода при псевдомембранозном колите может стать перитонит, обусловленный инфицированием брюшной полости микроорганизмами, содержащимися в каловых массах, или обезвоживание и нарушение функций различных органов и систем в результате интоксикации и грубых обменных расстройств.
Псевдомембранозный колит может рассматриваться, как внутрибольничная инфекция. Болезнь часто развивается при лечении в стационарных условиях, особенно — при пребывании в одной палате с пациентами, страдающими данной патологией. Факторами, увеличивающими вероятность развития псевдомембранозного колита и одновременно усугубляющими его течение, являются пожилой возраст, декомпенсированные соматические заболевания, болезни ЖКТ, бесконтрольный прием антацидов, почечная недостаточность, злокачественные опухоли, иммунные нарушения (в том числе — при СПИДе), ослабление организма после обширных хирургических вмешательств, а также состояния различного генеза, требующие проведения интенсивной терапии.
Симптомы колита
Клиническая картина псевдомембранозного колита определяется тяжестью патологии. При легких формах наблюдаются поносы и схваткообразные боли в животе на фоне ухудшения общего состояния организма. Стул обильный, водянистый, возможно — с примесями слизи. Общая интоксикация при псевдомембранозном колите проявляется в виде повышения температуры тела, слабости, разбитости, головной боли, тошноты и рвоты. Выраженность диареи и интоксикационного синдрома могут различаться. Все признаки исчезают после отмены антибиотиков.
При тяжелой форме болезни и псевдомембранозном колите средней степени тяжести клиническая симптоматика сохраняется в течение 1-2 и более недель после прекращения антибиотикотерапии. Пациенты страдают от изнуряющей диареи. Кал приобретает специфический вид «рисового отвара» желтоватой или зеленоватой окраски. В каловых массах больных псевдомембранозным колитом выявляются примеси слизи и крови. Потери значительных количеств жидкости с калом обуславливают развитие дегидратации и расстройств водно-электролитного обмена, проявляющихся слабостью, учащением пульса, снижением артериального давления, нарушением тонуса мышц и парестезиями. Возможны судороги. Отмечается уменьшение количества выделяемой мочи.
Отличительными особенностями тяжелой формы псевдомембранозного колита являются более бурное течение и появление крови в фекальных массах с первых дней заболевания. Наблюдается быстрое нарастание интоксикации, в сочетании с интенсивными схваткообразными болями в левой половине живота (преимущественно — в проекции сигмовидной кишки). Тяжелым осложнением псевдомембранозного колита может стать образование патологического расширения кишечника (мегаколона) с последующим разрывом кишки и развитием перитонита. О развитии мегаколона свидетельствует ухудшение состояние пациента с гипертермией до 39 градусов и выше в сочетании с уменьшением частоты дефекаций и увеличением объема живота.
У некоторых пациентов с псевдомембранозным колитом выявляется реактивный артрит. Иногда наблюдается экссудативная энтеропатия — невоспалительное поражение кишечника, сопровождающееся нарушениями белкового обмена и гипопротеиновыми отеками, обусловленными потерей большого количества белка через желудочно-кишечный тракт. Известны случаи стремительного развития псевдомембранозного колита с быстрым обезвоживанием, развитием гиперкалиемии и последующей остановкой сердца.
Диагностика
Диагноз устанавливается специалистом-проктологом или гастроэнтерологом с учетом анамнеза (прием антибиотиков или других препаратов, способных спровоцировать развитие заболевания), жалоб, данных физикального исследования и дополнительных диагностических процедур. В ходе внешнего осмотра больного псевдомембранозным колитом врач отмечает гипертермию, артериальную гипотонию, тахикардию, увеличение объема живота и болезненность при пальпации. В общем анализе крови определяется лейкоцитоз. При исследовании кала выявляются кровь и слизь. При бактериологическом исследовании фекальных масс обнаруживаются Clostridium difficile.
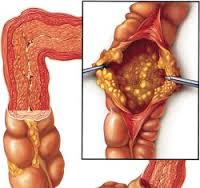
При проведении эндоскопического исследования у пациентов с псевдомембранозным колитом визуализируется слизистая оболочка, покрытая характерными желтоватыми фибринозными пленками (псевдомембранами). Обычно для подтверждения диагноза достаточно ректороманоскопии, поскольку псевдомембранозный колит чаще поражает дистальные отделы толстой кишки. В сомнительных случаях и при необходимости оценить состояние верхних отделов толстого кишечника проводят колоноскопию. При подозрении на развитие мегаколона назначают радиологические исследования (КТ, рентгенографию).
Лечение псевдомембранозного колита
Лечение данной патологии преимущественно консервативное. Больным отменяют антибиотики, назначают специальную диету, рекомендуют употреблять больше жидкости для предупреждения дегидратации. При легких формах псевдомембранозного колита этиотропные препараты обычно не требуются. При среднетяжелой и тяжелой форме болезни используют метронидазол. При наличии противопоказаний к применению данного препарата проводят терапию ванкомицином. Для восстановления нормальной микрофлоры кишечника назначают препараты бифидум и лактобактерий.
При тяжелых формах псевдомембранозного колита осуществляют инфузионную терапию для восстановления объема жидкости, устранения интоксикации, коррекции потерь белка и электролитных нарушений. При псевдомембранозном колите, осложненном токсическим мегаколоном, показано хирургическое вмешательство — сегментарная резекция пораженной части кишечника. Перфорация кишки является показанием к проведению неотложной операции — удалению пораженного отдела кишки, промыванию и дренированию брюшной полости для предупреждения развития перитонита.
Прогноз и профилактика
Прогноз при псевдомембранозном колите определяется тяжестью заболевания. Средняя вероятность гибели пациентов с данной патологией при отсутствии лечения составляет около 30%. При легких формах псевдомембранозного колита обычно наблюдается выздоровление после прекращения антибиотикотерапии. При колитах средней тяжести клиническая симптоматика сохраняется в течение нескольких недель, в последующем возможны рецидивы. Тяжелые формы псевдомембранозного колита часто завершаются гибелью пациентов. Шансы на благополучный исход при мегаколоне и перфорации кишечника еще больше снижаются, поскольку оперативные вмешательства приходится проводить в условиях резкого ослабления организма больного. Кроме того, перфорация толстой кишки часто осложняется перитонитом даже при раннем оперативном вмешательстве, что обусловлено наличием большого количества бактерий в кишечном содержимом.
Основной профилактической мерой является обоснованное назначение антибиотиков, выбранных с учетом индивидуальных противопоказаний, состояния больного и риска развития псевдомембранозного колита. Необходимо одновременное использование средств для предупреждения дисбактериоза, особенно — при продолжительной антибиотикотерапии. В группу высокого риска возникновения псевдомембранозного колита включают больных в возрасте старше 65 лет и пациентов, постоянно принимающих средства из группы антагонистов гистаминовых рецепторов. Больным из этой группы не рекомендуется назначать антибиотики, часто провоцирующие псевдомембранозный колит.
Источник
Псевдомембранозный энтероколит и его лечение.
 Но что же делать, если все же антибактериальный препарат обусловил появление псевдомембранозного энтероколита?
Но что же делать, если все же антибактериальный препарат обусловил появление псевдомембранозного энтероколита?
В первую очередь следует верифицировать болезнь.
Во вторую провести качественное лечение.
Только тяжелый псевдомембранозный энтероколит, при котором выраженный понос стал причиной тяжелого обезвоживания и усиления интоксикации организма, требует лечения в условиях стационара с применением антибактериальных препаратов!? Да-да! Все тех же антибактериальных препаратов, но способных уничтожить Clostridium difficilе.
Традиционно используются метронидазол (внутрь или внутривенно) или гликопептид ванкоминин. В настоящее время обсуждается возможность использования для этих целей современных макролидов или фторхинолонов, высокоэффективных и относительно безопасных антибактериальных средств. Курс лечения антибактериальными препаратми обычно не превышает двух недель.
Вторым этапом лечения псевдомембранозного энтероколита является назначение ионобменных смол (холестипол, холестирамин) или других сорбентов до 4,0-8,0 г в сутки в течение 1-2 недель. Основная цель — выведение из пищеварительного тракта токсинов Clostridium difficilе. В настоящее время целесообразность использования этих препаратов признается не всеми специалистами.
Третьим и самым продолжительным этапом лечения псевдомембранозного энтероколита является введение пробиотиков, лекарственных препаратов, состоящих из достаточно большого количества микроорганизмов, которые должны удовлетворять следующим требованиям: оставаться стабильными и жизнеспособными при хранении, а при попадании в пищеварительный тракт, они должны выживать в среде кишечника, и при этом оказывать положительное действие на организм человека. В настоящее время на роль пробиотиков претендуют не только штаммы молочнокислых бактерий, но и разновидности бацилл (Bacillus), бифидобактерий (Biftdobactcriа), энтерококков (Entеrococci), дрожжевых грибов (Saccharomycеs boulardii). Кроме живых микроорганизмов, с лечебной целью используются их различные формы: «высушенные и замороженные», просто «высушенные», «растворенные в молоке», убитые путем нагревания, а также различные их сочетания. Учитывая большую популярность среди населения пробиотиков не только в качестве средств лечения и профилактики кишечных заболеваний, но и в «оздоровлении» организма (что активно «подогревается» рекламой), остановимся на разных аспектах их использования более подробно.
Потенциально существует три различных пути введения пробиотиков:
- через прямую кишку ретроградно в толстую кишку,
- внутрь в составе молочных продуктов (йогурта, молочнокислых изделий),
- внутрь в кишечно-растворимых капсулах, содержащих «высушенные» живые бактерии.
Казалось бы, первый путь введения пробиотиков более естественный и позволяет использовать полный спектр необходимых микроорганизмов. Но он не получил достаточного научного обоснования, к тому же сопряжен с определенными сложностями как для врача, так и для пациента, в том числе не исключает опасность заражения патогенными микроорганизмами, включая ВИЧ-инфицирование.
Использование молочных продуктов также может стать причиной ряда трудно разрешимых проблем, как то, ограниченный срок их годности даже при хранении в холодном месте (что тоже не всегда возможно), необходимость приема достаточно большого объема, что нередко может вызвать тошноту, тяжесть в желудке (особенно актуально для пожилых пациентов, которые в своем большинстве употребляют достаточно небольшое количество пищи). Именно поэтому наиболее часто используют третий — капсульный путь введения в организм пробиотиков.
Наряду с уже перечисленными свойствами, пробиотики должны удовлетворять следующим требованиям:
- При совместном использовании с антибактериальными средствами в лечении кишечных инфекций или для профилактики вызванной антибиотиками диареи микроорганизмы должны обладать устойчивостью (резистентностью) к антибиотикам
- Не передавать патогенной флоре свою естественную или приобретенную (при попадании в кишечник) устойчивость к антибиотикам
- На фармакодинамическом уровне демонстрировать механизмы действия, с помощью которых можно было бы объяснить эффективность пробиотика в лабораторных условиях (in vitro), в организме (in vivo)
- Подтверждать свою лечебную и профилактическую эффективность в качественно спланированных (многоцентровых рандомизированных плацебо-контролируемых двойных слепых) исследованиях, отвечающих требованиям доказательной медицины.
К сожалению, большинство «претендентов» на звание пробиотиков не в полной мере удовлетворяют столь жестким требованиям, которые современная медицина использует в оценке эффективности лекарственных препаратов.
Так молочнокислые бактерии разрушается под воздействием содержащейся в желудке соляной кислоты и находящейся в кишечнике желчи. Это в первую очередь касается находящихся в йогурте бактерий Lactobacillus bulgaricus и S.thermophilus, которые имеют слабую устойчивость к вышеназванным агрессивным средам, тогда как Lactobacillus acidophilus и бифидобактерии более устойчивы, хотя и между их штаммами существует очень большая разница. Весьма большое значение имеет субстрат, вместе с которым вводятся молочнокислые бактерии. Наибольшую устойчивость к соляной кислоте желудка имеют Lactobacillus acidophilus, содержащиеся в молоке, несколько меньшую — в йогурте, еще меньшую — в пахте.
Несмотря на наличие у ряда микроорганизмов в лабораторных условиях (in vitro) способности подавлять рост грамположительных и грамотрицательных бактерий и разрушать их за счет выработки перекиси водорода, доказать аналогичный эффект в живом организме (in vivo) пока не удается. Штамм LA 1 Lactobacillus acidophilus in vitro способен склеиваться с клетками (адгезия), которые подобны тем, что выстилают слизистую кишечника. Тем самым пробиотик препятствует прикреплению болезнетворных микроорганизмов (Е. coli и Salmonella typhimurium) к клетками слизистой кишечника, а также проникновению в них токсичных Е. coli, Yersinia pseudotuberculosis и Salmonella typhimurium.
Следует заметить, что это свойство штамм LA 1 Lactobacillus acidophilus проявляется лишь при отсутствии в кишечнике болезнетворных микробов, т.е. пробиотик эффективен лишь в качестве профилактического, а не лечебного средства. Попытка создать избыточную концентрацию лактобацил, которые могли бы конкурировать с патогенными микроорганизмами пока не увенчалось успехом, поскольку для достижения уровня защиты от адгезии токсичной для кишечника Е. coli (наиболее частой причины заболевания, известного под названием «диарея путешественников») требуются очень высокие концентрации микроорганизма, в десятки раз превышающие традиционно используемые.
Не получило серьезного научного подтверждения теоретически обоснованная способность некоторых лактобацилл (Lactobacillus casei GG и Lactobacillus casei rhamnosus) оказывать активирующее влияние на иммунную систему, препятствуя тем самым развитию инфекционных заболеваний. Ацидофильные лактобактерии, например Lactobacillus acidophilus при их добавлении в молоко не улучшают усвоения лактозы (молочного сахара), который входит в состав некоторых «лечебных» продуктов. Поэтому у пациентов с врожденным дефицитом лактазы, кишечного фермента, обеспечивающего метаболизм лактозы, потребление таких продуктов не только устранит диарею, но и может обеспечить ее усиления.
Кроме того, вводимые в качестве пробиотика лактобактерии могут стать причиной повышения внутрикишечной концентрации молочной кислоты с понижением рН в кишечнике (метаболический D-лактат-ацидоз), что может негативно отразиться на состоянии пациента. Это состояние еще больше усугубляется нерациональной антибиотикотерапией, стимулирующей рост грамположительных бактерий, устойчивых к назначаемым препаратам и вырабатывающих D-лактат.
Еще одной проблемой, которая может возникнуть на фоне лечения содержащими отдельные штаммы энтерококков и бацилл лекарственными препаратами является возможность, пусть даже теоретическая, развития септических состояний (эндокардит, менингит, пневмония). Имеются сообщения, в которых указанные заболевания развивались у ослабленных пациентов с онкопатологией, иммунодефицитом, принимавших в качестве пробиотиков Enicrococcus faccium, Bacillus suhtiiis. Среди возможных причин указанных ситуаций специалистами обсуждается возможность участия плазмид бактерий, входящих в состав названных микроорганизмов, в перекрестной передаче внутрикишечным микроорганизмам устойчивости к различным антибиотикам, включая ванкомицин (см. выше).
С другой стороны, большинство штамов Lactobacilli, Entcrococci, Bacillus cereus и Bifidobacteria чувствительны к таким антибиотикам, как амоксициллин (полусинтетический пенициллин), доксициклин (тетрациклин), фторхинолонам, цефалоспоринам. Поэтому при совместном их применении ожидать нормализации кишечной микрофлоры просто не приходиться, даже при парентеральном (внутримышечном или внутривенном) назначении противомикробных средств.
Проведенные в конце прошлого века клинические испытания в своем большинстве не обнаружили значимую эффективность состоящих из Lactobacilli, Entcrococci, Bacillus и Bifidobacteria лекарственных препаратов в устранении клинических проявлений диареи, в том числе и обусловленной псевдомембранозным энтероколитом. Следует обратить внимание, что речь идет именно о лекарственных препаратах, а не о многочисленных содержащих названные микроорганизмы молочных продуктах, которые следует рассматривать лишь как пищевые добавки. Согласно международным стандартам, в их рекламе не должна использоваться медицинская терминология, например целесообразность использования в лечении и/или профилактике заболеваний или их симптомов. Благодаря этому любой потребитель должен четко знать, что является лекарственным препаратом, а что — пищевым продуктом или добавкой к нему.
Несколько обособленно от перечисленных микроорганизмов стоят дрожжевые грибы (Saccharomycеs boulardii), которые выпускаются в замороженно-высушенной форме. При попадании в кишечник они демонстрирует не только высокую жизнеспособность, но и лечебно профилактические свойства в отношении многих заболеваний, сопровождающихся диареей, что подтверждено качественно спланированными и проведенными научными исследованиями. Saccharomycеs boulardii не инактивируются под влиянием соляной кислоты желудка и после их приема внутрь обнаруживаются в живом виде во всех отделах пищеварительного тракта. После прекращения приема в течение первых 5 дней грибы исчезают из кишечника. В отличие от описанных ранее микроорганизмов Saccharomycеs boulardii обладают естественной устойчивостью к большинству антибиотиков, сохраняя чувствительность к невсасывающимся противогрибковым препаратам (например, нистатину). Что касается современных всасывающихся противогрибковых препаратов (флуконалол и др.), то интервал приема в 6 и более часов уже не отражается на активности Saccharomycеs boulardii. Интересным свойством Saccharomycеs boulardii является повышение их содержания в кишечнике в ответ на нарушение естественной ее микрофлоры в результате приема антибиотиков.
Лечебный эффект Saccharomycеs boulardii в отношении патогенной микрофлоры, а точнее Clostridium difficilе, связывают со способностью конкурировать с клостридией за моносахариды, необходимый компонент метаболизма этого микроорганизма. Кроме того, Saccharomycеs boulardii вырабатывают специфические ферменты (протеазы), которые устраняют болезнетворное действие токсина Clostridium difficilе на клетки кишечника, что сопровождается снижением их проницаемости для метаболитов клостридий и подавлении секреции жидкости в просвет кишечника, уменьшая, тем самым, тяжесть течения псевдомембранозного энтероколита и его основного симптома — диареи. Дополнительный лечебный эффект Saccharomycеs boulardii объясняют их способностью улучшать питание клеток слизистой оболочки кишечника и повышать секрецию ими иммуноглобулинов (белковых веществ, обеспечивающих защиту организма от инфекции).
Именно благодаря этим свойствам Saccharomycеs boulardii демонстрируют свою эффективность в лечении острых и обострений хронических форм обусловленного нерациональной антибиотикотерапией псевдомембранозного энтероколита, а также его профилактике. Кроме, того, Saccharomycеs boulardii демонстрируют высокую эффективность в лечении и профилактике инфекционной диареи другой природы (например, «диареи путешественников»).
Традиционно, лекарственный препарат, содержащий Saccharomycеs boulardii, для лечения и профилактики инфекционной диареи, в том числе и обусловленной Clostridium difficilе, назначается по 1-2 капсулы 2 раза в день в течение 1-2 недель. Бывают ситуации, когда продолжительность приема препарата увеличивается до 3-4 недель.
Источник