Причинами некоронарогенного некроза миокарда могут быть
Содержание статьи
Некрозы миокарда: виды, этиология, патогенез
Август 22, 2018
Нет комментариев
Некротические повреждения сердечной мышцы, т. е. гибель участков миокарда, бывают связаны или не связаны с нарушением коронарного кровообращения. В зависимости от этого они подразделяются на коронарогеннш и некоронарогенные некрозы.
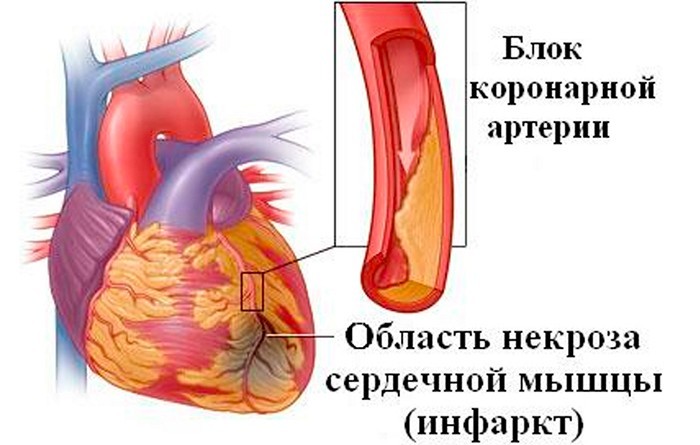
Коронарогенные (ишемические) некрозы миокарда
Некроз миокарда, возникающий вследствие ухудшения коронарного кровотока (ишемии), называется инфарктом миокарда.
Некроз инфаркт миокарда
представляет собой одну из острых форм ИБС, при которой доставка к сердцу кислорода и питательных веществ не удовлетворяет потребности сердца в этих веществах.
Этиология
В этиологии инфаркта миокарда играют важную роль атеросклероз коронарных артерий, их тромбоз, спазм и (достаточно редко) эмболия коронарных артерий. К факторам риска инфаркта миокарда можно отнести все те, которые указаны как факторы риска ИБС (см. начало данного раздела). Сочетание двух или трех факторов риска увеличивает вероятность возникновения инфаркта миокарда.
Патогенез
Выделяют следующие последовательно развивающиеся стадии в патогенезе инфаркта миокарда.
1. Выключение дыхательной цепи митохондрий и активация гликолиза как следствие начавшейся ишемии. Накопление недоокисленных продуктов метаболизма (прежде всего молочной кислоты) обусловливает появление боли.
2. Ингибирование основных метаболических путей, подавление гликолиза (из-за слишком большого снижения pH в ткани миокарда) и цикла Кребса, вследствие чего развивается дефицит аденозинтрифосфата. Наблюдается накопление жирных кислот вследствие угнетения их р. окисления, а также нарушение ионного равновесия в кардиомиоцитах
3. Разрушение мембран кардиомиоцитов в результате включения в патогенез инфаркта так называемой липидной триады. В нее входят активация липаз и фосфолипаз, активация свободнорадикального перекисного окисления липидов и детергентное действие на миокард избытка жирных кислот. Все указанные изменения происходят в мембранах сарколеммы, лизосом, саркоплазматического ретикулума и митохондрий и приводят к их повреждению и повышению проницаемости. Следствием этого является выход аутолитических ферментов лизосом в клетки миокарда, а также накопление в них избытка свободного Са++. Избыток Са++ вызывает контрактуру миофибрилл и приводит к дальнейшей активации липаз и фосфолипаз.
4. Заключительная стадия необратимых повреждений кардиомио-цитов и некроз ишемического участка миокарда.
Клинические проявления
Основными клиническими симптомами инфаркта миокарда являются:
1. Локализующаяся за грудиной сильнейшая боль, иррадиирующая в левое плечо, левую руку и межлопаточную область. Эта боль может возникать в покое днем или в ночное время.
В отличие от приступа стенокардии болевой синдром при инфаркте миокарда длится дольше и не купируется повторным приемом нитроглицерина. Следует отметить, что в тех случаях, когда болевой приступ длится более 15 мин, а принимаемые меры неэффективны, необходимо немедленно вызвать бригаду скорой медицинской помощи.
Встречаются и атипичные формы инфаркта миокарда, при которых характерные симптомы, в частности болевой синдром, могут отсутствовать (безболевая форма инфаркта миокарда).
2. Ослабление сократительной способности миокарда вследствие выпадения из акта сокращения поврежденного участка миокарда ведет к уменьшению сердечного выброса. При этом в зоне некроза с помощью эхокардиографии могут выявляться различные нарушения движения стенки поврежденного желудочка: акинезия, гипокинезия, дискинезия (выбухание участка инфаркта в момент систолы). Последнее может свидетельствовать о формировании острой аневризмы сердца-
3. Аритмии. В связи с изменением в зоне инфаркта биоэлектрических свойств кардиомиоцитов возникают нарушения сердечного ритма (вплоть до развития фибрилляции сердца), что приводит к значительным расстройствам системной гемодинамики и усугубляет нарушение контрактильной функции сердца. Источником эктопической активности на ранних стадиях развития инфаркта служит, как правило, окржающая зону некроза так называемая паранекротическая зона.
4. Появление типичных изменений ЭКГ. К ним относятся смещение сегмента ST выше или ниже относительно изоэлектрической линии, появление патологического комплекса QS (свидетельствует о наличии в миокарде очага глубокой ишемии или некроза), а также появление гигантского зубца Т. Он может быть положительным или отрицательным. Если подобный зубец Т появляется в раннем периоде инфаркта миокарда, его трактуют (как и смещение сегмента ST) как проявление острой ишемии миокарда. Если же он появляется на поздних стадиях, его связывают с формированием в миокарде рубцовых изменений.
В зависимости от особенностей изменений ЭКГ различают следующие формы инфаркта миокарда:
• Q-образующий инфаркт, или Q-инфаркт (с формированием патологического глубокого зубца Q, что может свидетельствовать о крупноочаговом трансмуральном инфаркте);
• Q-необразующий инфаркт, или He-Q-инфаркт (сопровождается не появлением зубца Q, а появлением отрицательного зубца Т, что свидетельствует о мелкоочаговом инфаркте миокарда).
5. В крови повышается содержание так называемых маркеров инфаркта миокарда: миокардиальной фракции креатинфосфокиназы, миоглобина, а также тропонина-Т, который имеет на сегодняшний день наиболее важное значение в диагностике инфаркта миокарда.
6. Одно из важных проявлений инфаркта миокарда – ухудшение реологических свойств крови, что способствует тромбообразованию. При инфаркте миокарда венозный тромбоз диагностируется у 10-15 % больных.
7. Кроме описанных выше изменений могут наблюдаться расстройства мозгового кровообращения, нарушения функции желудочно-кишечного тракта. Через несколько часов от начала инфаркта миокарда развивается лейкоцитоз. Весьма характерно для инфаркта появление так называемого симптома перекреста между числом лейкоцитов в крови и СОЭ, когда в конце 1-й недели выраженность лейкоцитоза снижается, а СОЭ увеличивается.
Осложнения
К ранним осложнениям относят острую сердечную недостаточность, кардиогенный шок, отек легких, механические осложнения (разрыв папиллярных мышц, перегородки и стенок миокарда), тампонаду сердца, перикардит, тромбоэмболию легочной артерии, являющуюся одной из наиболее частых причин внезапной смерти.
К поздним осложнениям (возникают через 2-3 нед. и более от начала инфаркта) относят постинфарктный синдром Дресслера, хроническую недостаточность кровообращения, развитие аневризм сердца, тромбоэмболию легочной артерии и повторные инфаркты миокарда. Что касается синдрома Дресслера, то он возникает через 2-6 нед. от начала инфаркта и проявляется перикардитом, плевритом и пневмонией. В его патогенезе играет роль образование аутоантител к деструктивно измененным при инфаркте белкам миокарда — миокардиальным аутоантигенам.
Принципы патогенетической терапии
1. Ликвидация болевого приступа с помощью сильнодействующих анальгетиков и наркотических средств.
2. Использование антиагрегантов и тромболитических препаратов. В качестве доврачебной помощи рекомендуется использовать аспирин.
3. Уменьшение потребности сердца в кислороде, улучшение его доставки и снижение риска возникновения аритмий ф-адреноблокаторы).
Рекомендуется также использовать:
• ингибиторы ангиотензинпревращающего фермента;
• седативные и снотворные препараты;
• противоаритмические средства.
4. Важное значение имеют и хирургические методы лечения, в частности аортокоронарное шунтирование и баллонная ангиопластика со стентированием коронарных артерий.
Некоронарогенные (неишемические) некрозы миокарда
Поражения сердца этого типа возникают как результат нарушения метаболизма в сердечной мышце в связи с действием на сердце избытка электролитов, гормонов, токсических продуктов обмена, кардиальных аутоантител. Различают следующие виды некоронарогенных некрозов миокарда.
Электролитно-стероидные некрозы
Образование данного вида некрозов связано с патогенным действием на миокард избытка вводимых в организм гормонов коры надпочечников (прежде всего минералокортикоидов) в сочетании с солями натрия. Такое воздействие приводит к увеличению проницаемости мембран кардиомиоцитов для натрия и накоплению его в сердце. Развивающийся впоследствии отек и «осмотический взрыв» клеток миокарда сопровождается возникновением очагов некроза.
Катехоламиновые некрозы миокарда
Повреждающее действие избыточных концентраций катехоламинов на сердце объясняется следующими механизмами.
Во-первых, сами катехоламины, и прежде всего адреналин, обладают прямым повреждающим действием на миокард.
Во-вторых, несмотря на то что катехоламины расширяют коронарные сосуды, они в значительно большей степени увеличивают потребность сердца в кислороде, т. к. повышают частоту сердечных сокращений и артериальное давление. Поэтому при прохождении крови по венечным сосудам кислород утилизируется раньше, чем кровь достигнет прекапиллярного отдела микрососудистого русла. Это приводит к тому, что в миокарде появляются участки, получающие кровь, обедненную кислородом.
В-третьих, под влиянием избытка катехоламинов в миокарде происходит активация перекисного окисления липидов, продукты которого повреждают мембраны кардиомиоцитов.
Токсические и воспалительные некрозы миокарда
Данные виды некрозов возникают при интоксикации или поражении миокарда воспалительным процессом. Токсический миокардит может возникать вследствие воздействия некоторых химических соединений и фармакологических препаратов, например кокаина, лекарственных средств, применяемых при лечении злокачественных опухолей. Эти токсические вещества оказывают прямое повреждающее действие на миокард, приводя к развитию необратимой дистрофии и появлению мелкоочаговых некрозов.
Примером воспалительных некрозов миокарда служат различные миокардиты: ревматические и дифтерийные. При любом воспалительном процессе, как и в данном случае, наблюдается альтерация (повреждение) миофибрилл. Развивающийся воспалительный отек также способствует альтерации. Все это ведет к развитию микронекрозов миокарда.
Аутоиммунные некрозы
Одним из примеров аутоиммунных некрозов миокарда служит синдром Дресслера, о котором было сказано выше.
Поврежденные белки при инфаркте миокарда могут стать аутоантигенами, к которым в организме вырабатываются антитела. Повторное развитие некротического процесса обусловливает запуск реакции «антиген-антитело» во многих участках сердечной мышцы, что вызывает множественные микронекрозы.
Загрузка…
Источник
Некоронарогенные некрозы миокарда
Некроз участка миокарда в клинике чаще всего вызывается редукцией коронарного кровотока и называется инфарктом миокар
да. Наряду с этим некроз миокарда может сформироваться и при неповрежденных коронарных артериях. Такие некрозы называют некоронарогенными. Речь идет, в первую очередь, об экспериментальных моделях. Однако и в клинике имеют место подобные механизмы развития некрозов.
- 1. Катехоламиновая модель. Высокие концентрации адреналина и норадреналина вызывают резкое усиление функций сердца, и возникает несоответствие между возросшей метаболической потребностью и неизменной реальной доставкой крови по коронарным артериям. Дополнительное значение имеет прямое повреждающее действие токсических концентраций катехоламинов на миокард.
- 2. Гипоксическая модель. Гипоксия различного типа: экзогенная, дыхательная, гемическая, может привести к развитию некроза из- за недостатка кислорода.
- 3. Электролитно-стероидная модель. При введении крысам значительного количества солей натрия и стероидных гормонов развиваются дегенеративно-некротические очаги в миокарде. Хотя механизмы развития электролитно-стероидных некрозов окончательно не выяснены, тем не менее в общих чертах его можно представить следующим образом. Кортикостероиды повышают проницаемость мембран кардиомиоцитов для ионов натрия, которые в избыточном количестве входят в клетку, нарушая ее гидратацию. Происходит «осмотический взрыв» клетки, ее гибель и возникновение очага некроза. В клинике такие некрозы могут возникать в условиях гиперфункции надпочечников, а также при терапии каких-либо заболеваний кортикоидами.
- 4. Токсические и воспалительные некрозы. Такие некрозы возникают в условиях интоксикации или поражения миокарда воспалительным процессом. В первом случае токсический фактор разрушает миокардиальные волокна, вызывая их некроз, а во втором (при ревматическом или дифтерийном миокардите) — часть волокон альтерируется непосредственно самим воспалительным процессом, а часть сдавливается экссудатом и также гибнет. В итоге развиваются мелкоочаговые некрозы миокарда, носящие диффузный характер.
- 5. Иммунные повреждения сердца развиваются при введении в организм экспериментального животного гетерогенной сыворотки, содержащей антитела к белкам сердца животного данного вида [1, 6, 9]. В клинике подобная ситуация может возникнуть при выработке аутоантител к антигенам кардиомиоцитов. Возникая на фоне повторных инфарктов миокарда, аутоиммунные некрозы значительно осложняют их течение. Продукты тканевого распада, образующиеся при некрозе миокарда, могут стать аутоантигенами, к которым в организме вырабатываются антитела. Повторное развитие некробиотического процесса обусловливает запуск реакции «антиген-антитело» во многих участках сердечной мышцы, вызывает множественные микроинфаркты, а также тромбообразование и обтурацию тромбами капилляров и мельчайших артериальных сосудов. В результате резко снижается сократимость миокарда, нарушаются процессы клеточной биоэнергетики, а с учетом того, что эти явления развиваются на фоне уже имеющегося инфаркта, это обычно заканчивается острой сердечной недостаточностью и смертью больного.
Источник
Некоронарогенные некрозы миокарда.
Поражения
сердца такого типа возникают как
результат нарушения обменных процессов
в сердечной мышце в связи с действием
электролитов, гормонов, токсических
продуктов обмена. Различают следующие
виды некоронарогенных некрозов миокарда:
1.Электролитно-стероидные
некрозы. В
начале 50-х годов прошлого столетия
канадским биохимиком и патологом Г.
Селье было показано, что если белым
крысам в течении длительного времени
вводить гормоны коры надпочечников, в
частности кортизон и дезоксикортикостерон-
ацетат (или их аналоги), а также содержать
животных на диете, включающей большое
количество однозамещенного фосфата
натрия, то через 11- 12 дней с начала
эксперимента в миокарде у животных
отмечается появление участков некроза.
Введение одних гормонов без натрия не
приводило к возникновению некротических
изменений в сердечной мышце. Таким
образом, выявилась роль натрия, как
важнейшего фактора, вызывающего некрозы
миокарда. По-видимому, кортикоиды
повышают проницаемость миокардиальных
клеток для натрия. Последний в избыточном
количестве входит в клетку, нарушая ее
гидратацию, происходит “осмотический
взрыв” клетки, ее гибель и возникновение
очага некроза.
В условиях
гиперфункции надпочечников, а также
при терапии кортикоидами необходимо
учитывать возможность возникновения
этих некрозов и проводить у таких
больных соответствующую профилактику,
в частности, назначить бессолевую
диету.
2.Катехоламиновые
некрозы.
При ряде состояний, в частности при
эмоциональных возбуждениях, в кровь
выделяется большое количество
катехоламинов: адреналина и норадреналина.
При повышении концентрации катехоламинов
в крови они начинают накапливаться в
миокарде. Если в малых дозах катехоламины
стимулируют энергетический обмен, то
в больших концентрациях начинает
превалировать их гистотоксический
эффект. Происходит исчезновение запасов
гликогена из сердечной мышцы; распад
макроэргических фосфорных соединений
начинает преобладать над их синтезом.
Кроме того, катехоламины резко повышают
потребность миокарда в кислороде и,
несмотря на расширение венечных сосудов,
доставка кислорода с кровью начинает
отставать от потребности в нем
кардиальных структур. Вследствие этого
участки миокарда, кровоснабжаемые
концевыми капиллярами, не получают
кислорода; возникает их гипоксия и
развиваются некрозы.
3.Токсические и
воспалительные некрозы
возникают в условиях интоксикации или
поражения миокарда воспалительным
процессом. В первом случае токсический
фактор разрушает миокардиальные
волокна, вызывая их некроз. При
воспалительных процессах (ревматический,
дифтерийный миокардиты) часть волокон
разрушается непосредственно самим
воспалительным процессом, а часть
сдавливается воспалительным отеком и
также гибнет. В обоих случаях (и при
интоксикациях, и при воспалениях)
наблюдаются мелкоочаговые некрозы
миокарда, носящие диффузный характер.
Возникновение
ишемических участков в миокарде,
некрозов наряду с нарушением сократительной
функции сердца приводит к одному из
наиболее частых проявлений сердечной
патологии — к аритмиям.
Сердечные
аритмии
Аритмиями
называются
нарушения периодичности, частоты или
силы сердечных сокращений, возникающие
в результате патологии основных свойств
миокарда: автоматизма, возбудимости,
проводимости и сократимости.
1.Патология
сердечного автоматизма
заключается в изменении деятельности
сино-аурикулярного узла и нарушении
субординационных взаимоотношений в
проводниковой системе сердца. Основными
проявлениями нарушений автоматизма
являются следующие:
А. Синусовая
тахикардия.
Синусовой тахикардией называется
учащение сердечного ритма выше границ
относительной нормы для данного возраста
при спокойном положении тела, при
импульсации, исходящей из сино-аурикулярного
узла. Причинами синусовой тахикардии
могут быть: усиление симпатических или
ослабление парасимпатических влияний
на миокард, а также непосредственное
раздражение синусного узла токсическим,
пирогенным и другими агентами. Синусовая
тахикардия не представляет самостоятельной
патологии, но указывает на изменение
регуляции сердечной деятельности.
Появление синусовой тахикардии в
экстремальных состояниях (шок, коллапс
и т. д.) является благоприятным
прогностическим признаком, так как
свидетельствуют о сохранении определенных
резервных сил сердца.
Б. Синусовая
брадикардия.
Синусовой брадикардией называется
урежение сердечного ритма ниже границ
относительной нормы для данного возраста
при спокойном положении тела при
импульсации, исходящей из сино-
аурикулярного узла. Синусовая брадикардия
может возникнуть из-за усиления
парасимпатических или ослабления
симпатических влияний на миокард, а
также непосредственного угнетения
деятельности синусного узла токсическими
агентами. Появление синусовой брадикардии
в экстремальных состояниях является
неблагоприятным прогностическим
признаком, так как свидетельствеут об
угнетении сердечной деятельности и
истощении функциональных резервов
сердца.
В. Синусовая
аритмия.
Синусовая аритмия проявляется
периодически сменяющими друг друга
учащениями и урежениями сердечного
ритма при сохраненной синусной
импульсации. Она связана с периодическим
изменением тонуса блуждающих нервов
(повышение тонуса на выдохе и снижение
на вдохе). В норме синусовая аритмия
незаметна, так как она корригируется
центральными нервными влияниями, но в
условиях глубокого сна, наркоза, когда
ослабевают корковые влияния, а также
в раннем детском возрасте, когда не до
конца сформированы центральные
механизмы, она может быть выраженной.
Появление синусовой аритмии при шоке,
коллапсе и других экстремальных
состояниях является неблагоприятным
прогностическим признаком, так как
свидетельствует о глубоких нарушениях
в деятельности центральной нервной
системы.
Г. Узловой
ритм. Узловым
ритмом называется состояние, при котором
вследствие подавления деятельности
сино-аурикулярного узла роль водителя
ритма берет на себя атриовентрикулярный
узел. При этом темп сердечных сокращений
резко замедляется (с 70-90 до 40-60 уд.в
мин.). Причинами возникновения узлового
ритма могут быть различные факторы
(токсины микробов, химические яды,
ишемия), резко угнетающие
деятельность сино-аурикулярного узла.
Импульсация из атриовентрикулярного
узла распростряняется как вниз на
желудочки, так и вверх на предсердия.
При достаточно низком расположении
водителя ритма может наступить такая
ситуация, когда и предсердия, и желудочки
возбудятся и сократятся одновременно.
Произойдет “закупорка предсердий”,
вследствие чего сердечный ритм нарушится
еще больше и даже может наступить
мерцание предсердий. Клинически
закупорка предсердий проявляется
резкими перебоями в деятельности
сердца, головокружением и даже обмороком.
Д. Идиовентрикулярный
ритм. Это
нарушение сердечного ритма возникает
в том случае, когда патогенный агент
глубоко повреждает не только синусный,
но и атриовентрикулярный узел, и роль
водителя ритма берут на себя желудочковые
центры автоматизма. Ритм резко урежается
(10-30 уд.в мин.); часто возникают явления
закупорки
2. Патология
возбудимости.
Из этой группы аритмий наиболее важное
значение в клинике имеют: экстрасистолия,
пароксизмальная тахикардия и мерцательная
аритмия.
Экстрасистолия
(возникновение экстрасистолы)- это
внеочередное сокращение сердечной
мышцы, возникающее в ответ на возбуждение,
исходящее из гетеротопного (эктопического)
очага, то есть центра, расположенного
вне области номотопного водителя ритма.
Исключение составляют сино-аурикулярные
экстрасистолы, исходящие из области
синусного узла. В основе возникновения
экстрасистолы лежит разность
потенциалов,которая может возникнуть
в результате любого нарушения обмена
веществ в миофибриллах, ведущего к
изменению ионного баланса клетки. Такие
изменения метаболизма могут быть
результатом самых различных воздействий
на миокард, начиная от изменения уровня
его нейрогуморальной регуляции и кончая
тяжелой альтерацией при инфаркте или
миокардите.
В зависимости
от локализации эктопического очага
различают синусовые, предсердные,
атриовентрикулярные, левожелудочковые,
правожелудочковые и перегородковые
экстрасистолы. Одиночная экстрасистола
не вызывает серьезных расстройств
гемодинамической функции сердца и
клинически проявляется ощущением
«перебоя» сердечной деятельности.
Множественные экстрасистолы, и тем
более политопные, то есть исходящие из
нескольких эктопических центров, могут
серьезно нарушить функционирование
сердечной мышцы, что может привести к
значительному уменьшению сердечного
выброса. Кроме того, после экстрасистолы
следует компенсаторная пауза, то есть
удлиненная диастола, в период которой
миокард не восприимчив к номотопному
импульсу, а его реакция на гетеротопную
импульсацию резко извращенна, вплоть
до появления парабиотических фаз. В
том случае, если последующая экстрасистола
приходится в компенсаторную фазу
предыдущей, может возникнуть фибрилляция
желудочков сердца.
Пароксизмальная
тахикардия.
Этот вид патологии возбудимости
проявляется внезапным приступом резкого
учащения сердечного ритма. Число
сердечных сокращений при пароксизмальной
тахикардии может превышать 200 уд. мин.
Приступ может длиться от нескольких
секунд до нескольких часов и также
внезапно обрывается; клинически может
проявляться ощущением сердцебиений,
нехваткой воздуха, головокружением,
общей слабостью; в отдельных случаях
может происходить потеря сознания.
Измерение артериального давления в
этот период показывает значительное
уменьшение величины пульсового давления
за счет снижения максимального.
Пароксизмальная тахикардия наиболее
часто встречается при ишемических
поражениях миокарда, а также при
коронарокардиосклерозе. При пароксизмальной
тахикардии значительно уменьшается
ударный объем, минутный объем и происходит
нарушение кровоснабжения периферических
органов. При пароксизмальной тахикардии
резко укорачивается диастола, т.е.
период, в течение которого в миокарде
осуществляется ресинтез макроэргических
фосфорных соединений, развивается
энергетическое истощение сердечной
мышцы.
Мерцательная
аритмия (фибрилляция)
является одной из самых тяжелых форм
нарушения сердечного ритма. Суть этой
патологии сводиться к тому, что
миокардиальные волокна теряют
субординацию с водителем ритма и связь
друг с другом, в результате чего возникает
дискоординированое сокращение сердечной
мышцы, то есть отдельные волокна или
группы волокон возбуждаются и сокращаются
асинхронно.
Причины возникновения
мерцательной аритмии различны: поражение
электрическим током, ревматический
процесс ,инфаркт миокарда, нарушения
гормонального-электролитного баланса,
появление тромба в полости сердца. Во
всех случаях развитие мерцательной
аритмии свидетельствуют о далеко
зашедшем патологическом процессе.
Различают целый
ряд форм мерцательной аритмии, которые
входят в две основные группы: мерцание
предсердий и мерцание желудочков.
Принципиальная разница между этими
двумя группами заключается в том, что
с мерцанием предсердий люди могут жить
годами, так как нарушение гемодинамической
функции не вызывает летальных расстройств
сердечной гемодинамики в целом, а
мерцание желудочков приводит к
немедленной гибели организма, поскольку
сердце перестает функционировать как
насос.
Единственным
терапевтическим мероприятием,
прекращающим как фибрилляцию желудочков
сердца, так и стойкую мерцательную
аритмию предсердий, является
электроимпульсная терапия (электрическая
дефибрилляция) сердца. Разряд приводит
потенциал всех клеток к «нулевому»
уровню и субординирует их с номотопным
водителем ритма.
3. Патология
проводимости.
В основе патологии проводимости лежит
нарушение распространения процесса
возбуждения по проводниковой системе
сердца.
Эти нарушения
могут быть вызваны токсическими,
ишемическими повреждениями миокарда,
а также возникать вследствие резкого
повышения тонуса блуждающих нервов,
которые обладают свойством нарушать
проводимость в волокнах проводниковой
системы. К нарушениям проводимости
может привести также кардиосклеротический
процесс, когда соединительная ткань
«прерывает» те или иные проводниковые
пути. Блоки проведения могут возникать
на самых различных уровнях, но наибольшее
значение в патологии имеют: поперечная
блокада сердца, возникшая на уровне
атриовентрикулярного узла, продольная
диссоциация, когда блокируется одна
из ножек пучка Гиса.
Поперечная
блокада сердца.
Различают четыре степени поперечной
блокады сердца:
а) поперечная
блокада І степени,
при которой наблюдается простое
удлинение интервала PQ. Удлинение этого
интервала свидетельствует о задержке
возбуждения в атриовентрикулярном
узле (АВ). Это расстройство сердечного
ритма чаще всего возникает при усилении
парасимпатических влияний на миокард;
б) поперечная
блокада ІІ степени,
при которой наблюдается периодическое
выпадание желудочкового комплекса.
Эта степень блокады проявляется
следующим образом. В каждом последующем
сердечном цикле интервал PQ удлиняется
все больше за счет снижения лабильности
АВ-области и, наконец, происходит
выпадение одного желудочкового
комплекса, после чего в течение этой
паузы восстанавливается лабильность
АВ-узла и интервал PQ вновь становится
нормальным, затем начинает снова
удлинятся и т.д. Клинически этот вид
поперечной блокады сердца проявляется
ощущением «перебоев»; серьезных
расстройств гемодинамики не возникает;
в) неполная
поперечная блокада.
При неполной поперечной блокаде через
АВ-узел проходит от предсердий на
желудочки не каждый импульс, а лишь 2-й
и 3-й и т.д. Гемодинамические нарушения
при неполной поперечной блокаде в связи
со значительным урежением сокращений
желудочков является достаточно
серьезными;
г) полная
поперечная блокада сердца.
При полной поперечной блокаде сердца
от предсердий на желудочки не проходит
ни одного импульса, предсердие сокращаются
в синусовом ритме, а желудочки — в
идиовентрикулярном. При поперечной
блокаде сердца возникают резкие
нарушения гемодинамики (иногда
несовместимые с жизнью) как вследствие
резкой желудочковой брадикардии, так
и в связи с часто возникающими явлениями
закупорки предсердий.
Наиболее тяжелым
осложнением поперечной блокады сердца
является синдром Морганьи-Эдемса-Стокса.
Он возникает в связи со следующими
обстоятельствами. При переходе сердца
на новый режим работы возникает так
называемое преавтоматическая пауза,
то есть остановка сердца, имеющая
продолжительность от нескольких секунд
до нескольких минут и проявляющаяся
клинически от обморочного состояния
до клинической смерти. Этот синдром
может возникать у больных до 10 раз в
сутки и является крайне тяжелым
страданием. Единственным надежным
методом терапии этого синдрома является
постоянная электрическая стимуляция
сердца с помощью искусственных водителей
ритма.
Продольная
блокада сердца.
Продольная блокада сердца возникает
чаще всего при механическом нарушении
(участок инфаркта, ревматическая
гранулема и т.д.)проведения возбуждения
по одной из ножек пучка Гиса. При этом
происходит асинхронное сокращение
желудочков, что при большой степени
выраженности этой патологии может
привести к значительным расстройствам
внутрисердечной гемодинамики.
4. Патология
сократимости.
Патология сократимости является
чрезвычайно многообразной. Однако
применительно к аритмиям выделяют
всего одну нозологическую форму –
альтернирующий пульс (pulsus alternans). При
этой патологии наблюдается чередование
нормальных и ослабленных сердечных
сокращений. Возникает альтернирующий
пульс при тяжелых интоксикациях и
воспалительных процессах в миокарде
и связан с удлинением рефрактерности
отдельных групп кардиальных волокон,
которые возбуждаются и вовлекаются в
сократительный процесс через одно
сокращение.
Некрозы, возникающие
в сердечной мышце, тяжелые формы аритмий
и другие заболевания сердца не только
нарушают общую гемодинамику, но и
снижают сократительную способность
миокарда, вызывая состояние, именуемое
сердечной
недостаточностью.
Соседние файлы в папке Патофизиология
- #
- #
- #
- #
- #
- #
- #
Источник