Отслоение слизистой оболочки мочевого пузыря
Содержание статьи
Лейкоплакия мочевого пузыря (Лейкокератоз мочевого пузыря, Лейкоплазия мочевого пузыря)
Лейкоплакия мочевого пузыря — это метаплазия (перерождение) уротелия в многослойный плоский эпителий, иногда с кератинизацией. Симптомы могут отсутствовать, иногда патология клинически проявляется учащенным с дискомфортом мочеиспусканием, ургентными позывами, синдромом хронической тазовой боли. Диагностика подразумевает цистоскопию с биопсией, окончательная верификация выполняется с помощью морфологического исследования. Лечение может быть консервативным — антибиотики, средства, улучшающие кровообращение, витамины, инстилляции или оперативным — направленным на ликвидацию патологических очагов.
Общие сведения
Лейкоплакия (лейкокератоз, лейкоплазия) мочевого пузыря встречается в 1:10 000 случаев. Сам термин подразумевает перерождение нормального переходного эпителия в патологический, нетипичный для слизистых — многослойный ороговевающий плоскоклеточный. Впервые состояние описано в 1862 году австрийским патологом К. Рокитанским, который обратил внимание на избыточное образование клеток с явлениями десквамации. Это наиболее опасный тип лейкоплакии, так как кератинизация либо сопутствует карциноме мочевого пузыря, либо имеет риск озлокачествления. Некератинизированный тип лейкоплакии встречается у женщин и маленьких детей (редко) и не представляет опасности.
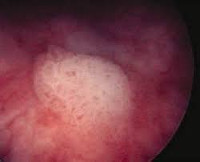
Лейкоплакия мочевого пузыря
Причины
Патогенез и этиология до настоящего времени остаются дискутабельными. Некоторые практики считают лейкоплакию мочевого пузыря гистологическими изменениями ткани при длительно существующем (более 2 лет) хроническом цистите с эпизодами рецидивирования. К состояниям, которые рассматривают в качестве возможных причин, относят:
- Хронические очаги инфекции в организме. В основном, это воспалительные заболевания тазовых органов, которые инициированы специфической (хламидия, микоплазма, герпес, ВПЧ) и неспецифической микрофлорой (кишечная палочка, стрептококк, протей). Патогены могут попадать в пузырь не только восходящим, но и гематогенным путем: из матки, кишечника, почек, кариозных зубов или миндалин. Рецидивирующий цистит рассматривается, как основная причина лейкоплакии.
- Эндокринные нарушения. Исследования показывают, что у пациенток с лейкоплакией менархе наступает позднее, в дальнейшем присутствуют нарушения менструальной функции: менометроррагия, бесплодие, нерегулярные ановуляторные циклы. Прием некоторых оральных контрацептивов способствует развитию гипоэстрогении, на фоне которой переходный эпителий мочевого пузыря заменяется многослойным плоским.
- Травмирующие факторы. Установленные искусственные дренажи, их замена, бужирование уретры приводят к постоянной травматизации и провоцируют метаплазию уротелия. В литературе встречаются данные о развитии лейкоплакии мочевого пузыря после оперативного лечения, лучевого воздействия, при цистолитиазе.
- Дистрофические нарушения. Нарушение кровоснабжения и иннервации стенки мочевого пузыря препятствует нормальной трофики органа. Ишемия нарушает состав муцинового слоя. Слизистая становится более рыхлой, что предрасполагает к внедрению бактерий и вирусов. Запоры, малоподвижный образ жизни, варикозное расширение вен малого таза — факторы, способствующие конгестии и недостаточной трофике тканей.
Нерациональный прием некоторых препаратов, курение, хронический алкоголизм и гиповитаминоз А с фоновой иммуносупрессией относят к факторам риска, способствующим атипичной дифференцировке клеток. В тропических странах метаплазия сопутствует шистосомозу ‒ паразитарному заболеванию, при котором яйца гельминтов могут находиться в мелких сосудах мочевого пузыря (мочеполовой шистосомоз).
Патогенез
Воспаление и другие этиофакторы вызывают нарушение общих и местных реакций иммунной системы, из-за чего на слизистой оболочке персистирует инфекционная и условно-патогенная микрофлора. Стойкое инфицирование, процессы альтерации и репарации приводят к метаплазии и фиброзу. В многослойном плоском эпителии, который является результатом нарушения цитодифференцировки, отсутствует гликогенобразование, и в ряде наблюдений возникает ороговение.
Моча оказывает раздражающее действие на видоизмененные клетки, оставшиеся без естественной защиты (утрата антиадгезивного фактора позволяет микробам задерживаться), что поддерживает воспаление и вызывает болевые ощущения, даже если была проведена адекватная антибактериальная терапия. Через разрушенный слой также происходит миграция ионов калия из мочи в интерстиций, что вызывает деполяризацию нервных окончаний, спазм гладкой мускулатуры, альтерацию кровеносных и лимфатических сосудов. Эти механизмы обеспечивают стойкую дизурию.
Классификация
Участки лейкоплакии могут быть единичными, но в тяжелых случаях белесые бляшки занимают значительную область мочевого пузыря. В формировании лейкоплакии выделяют 3 стадии: плоскоклеточная модуляция, плоскоклеточная метаплазия и присоединение кератинизации (ороговения). В зависимости от гистологических особенностей рассматривают:
- Некератинизированный подтип лейкоплакии. Встречается в области мочепузырного треугольника (также называется псевдомембранозным тригонитом), вариант нормы. Изменения регистрируют преимущественно у женщин, связи с химическими и физическими раздражителями нет, как и риска малигнизации. При появлении симптомов лечится эстрогенами.
- Кератинизированный подтип лейкоплакии. Патология чаще встречается у мужчин, связана с механическим воздействием. При ряде наблюдений регистрируют атипию, поэтому кератинизирующий подтип является фактором риска плоскоклеточного рака.
Учитывая то, что лейкоплакия мочевого пузыря — диагноз преимущественно гистологический, выставляемый на основании морфологического исследования, в практической урологии пользуются классификацией по стадиям — от этого зависит тактика ведения пациента. Выделяют три стадии патологического процесса:
- 1 стадия. Для нее характерны метапластические изменения переходного эпителия, которые не видны при выполнении цистоскопии и подтверждаются исключительно гистологически. Количество клеточных слоев увеличено в 2 раза, типично изменение формы верхних слоев (полигональная), пузырькообразные ядра с множественными ядрышками. Гистохимия показывает избыточное количество гликогена и прокератина.
- 2 стадия. Происходит дальнейшее видоизменение эпителия, что можно наблюдать при цистоскопии в виде беловатого или желтоватого налета на слизистой мочевого пузыря. Очаги единичные. Гистологическая картина представлена метапластическим многослойным плоским эпителием с типичной вертикальной дифференцировкой. Нижние слои составляют мелкие гиперхромные полигональные клетки, верхние клетки крупнее в размерах, содержат кератогиалин.
- 3 стадия. Процесс генерализуется, происходит распространение очагов лейкоплакии с вовлечением практически всей слизистой оболочки. Гистологические характеристики идентичны. Воспалительные изменения — утолщение стенок, отек, расширение и ломкость сосудов выражены значительно.
Симптомы
На 1 стадии какие-либо проявления отсутствуют, по мере прогрессирования заболевания появляются жалобы на затрудненное мочеиспускание с резями (53%), постоянные ноющие боли внизу живота (80%), непреодолимые позывы помочиться с недержанием урины (14%). Выраженный болевой синдром свидетельствует либо о тотальном поражении, либо о лейкоплакии шейки мочевого пузыря, особенно богатой нервными окончаниями.
При распространенном процессе симптомы могут быть настолько изнурительными, что значительно страдает качество жизни. Частота позывов на мочеиспускание даже ночью может достигать 5-6 раз в час. Поллакиурия присутствует у 83-95% больных. В запущенных случаях пациенты предъявляют жалобы на появление крови в моче в конце акта мочевыделения (терминальная гематурия), изменение ее качеств — нередко в осадок выпадают белые хлопья, лейкоциты, бактерии. Страдает психоэмоциональная сфера, присоединяются раздражительность, бессонница, подавленное настроение.
Осложнения
У 10-20% больных лейкоплакия мочевого пузыря с кератинизацией протекает с карциномой. Почти всегда на 3 стадии у женщин присоединяется диспареуния — болезненные ощущения при сексуальном контакте, ухудшение симптоматики после половой близости встречается у большинства пациенток. У мужчин лейкоплакия мочевого пузыря сопровождается эректильной дисфункцией. Фоновая рецидивирующая инфекция мочевыводящих путей выявляется практически у всех пациентов.
Рецидивирующий воспалительный процесс приводит к замещению нормальной функциональной ткани на фиброзную, что нарушает нормальное мочевыделение (нейрогенная дисфункция) и приводит к постоянному присутствию остаточной мочи. Неадекватное опорожнение становится причиной образования рефлюкса и пиелонефрита у трети пациентов, присоединения хронической почечной недостаточности в каждом пятом случае и цистолитиаза в 22-35%. Еще одно осложнение лейкоплакии — уменьшение емкости мочевого пузыря (микроцист) при частом мочевыделении и атрофии мышц.
Диагностика
Специфических изменений в общем анализе мочи, которые позволили бы однозначно подтвердить диагноз лейкоплакии мочевого пузыря, нет. Лечением патологии занимается специалист-уролог, при присоединении осложнений может быть полезна консультация нефролога, андролога. Алгоритм исследований при лейкоплакии может быть следующим:
- Лабораторная диагностика. В моче часто повышено количество лейкоцитов, бактерий, эритроцитов, могут присутствовать отслоившиеся чешуйки. Информативна ПЦР-диагностика на ИППП. Дополнительно выполняют культуральное исследование — посев мочи на питательные среды с целью определения возбудителей и чувствительности к лекарствам. У женщин исследуют гормональный профиль (эстрадиол, прогестерон, ФСГ).
- Инструментальная диагностика. Золотой стандарт — цистоскопия, во время которой в мочевом пузыре видны участки лейкоплакии. Из подозрительных мест берут образцы ткани для последующей морфологии, именно она позволяет верифицировать диагноз. УЗИ почек и органов малого таза назначают для уточнения состояния близлежащих структур и оценки возможных осложнений.
Дифференциальную диагностику проводят с циститом грибковой этиологии, для которого также характерны белесые налеты на слизистой органа. Похожая цистоскопическая картина наблюдается при малакоплакии — редком заболевании неизвестной этиологии с появлением желтоватых или беловатых бляшек, иногда с изъязвлениями. При мочеполовом туберкулезе и амилоидозе с помощью с помощью оптики можно увидеть очаги, которые напоминают лейкоплакию.
Лечение лейкоплакии мочевого пузыря
У женщин с некератинизированным подтипом лейкоплакии в отсутствие жалоб проводится динамическое наблюдение, при появлении неблагоприятной симптоматики назначают эстрогены. Лечение лейкоплакии с ороговением может быть на начальных стадиях консервативным (с обязательным наблюдением), далее рекомендован хирургический подход. В клинической практике применяется:
- Медикаментозное лечение. Назначают антибиотики с учетом чувствительности, противовирусные и противовоспалительные средства, иммуномодуляторы. На незапущенных стадиях хороший терапевтический эффект можно получить после инстилляций препаратов на основе гликозаминогликанов. При сопутствующем цистите в мочевой пузырь вводят антисептические растворы, масла с противовоспалительным и витаминизирующим действием, обезболивающие препараты.
- Физиотерапия. В качестве физиотерапевтического воздействия в составе комплексной терапии применяется магнитотерапия, электрофорез, лазеро- и микроволновая терапия. При физиотерапевтических сеансах уменьшается выраженность воспаления, улучшается трофика (что особенно актуально при лейкоплакии, связанной с дистрофическими нарушениями), повышается концентрация препарата в патологическом участке.
- Оперативное лечение. На 2-3 стадии выполняют хирургическое лечение. ИЛТ (интерстициальная лазерная терапия) и ТУР мочевого пузыря (трансуретральная резекция) — щадящие операции при лейкоплакии. При ИЛТ вероятность присоединения осложнений меньше. Цистэктомия в настоящее время выполняется редко и только при обширном поражении.
Прогноз и профилактика
Прогноз зависит от стадии заболевания и подтипа лейкоплакии, при отсутствии кератинизации он благоприятный. При лейкоплакии с кератинизацией на 1-2 стадии прогноз удовлетворительный при своевременном обращении, поддерживающем лечении и регулярном наблюдении с целью раннего выявления возможной малигнизации. На продвинутой стадии после успешно выполненного хирургического лечения исход относительно благоприятный. К инвалидизации пациента и социальной дезадаптации приводит распространенная форма заболевания с развитием осложнений.
Профилактика подразумевает своевременное обращение к урологу при первых симптомах неблагополучия со стороны органов мочеполовой сферы, адекватное лечение воспалительной патологии, отказ от вредных привычек, рациональный прием препаратов. Учитывая, что цистит ‒ основной патогенетический фактор в развитии лейкоплакии ‒ может вызываться ИППП, целесообразно придерживаться моногамных отношений или использовать барьерные средства защиты при случайных половых контактах.
Источник
Формы хронического цистита
Автор: Андреева Е. А., ветеринарный врач-терапевт Ветеринарной клиники доктора Сотникова, г. Санкт- Петербург, ул. Репищева, 13, 2019 г.
Сокращения: ИМП — инфекция мочевыводящих путей, МП — мочевой пузырь, ГАК — гиперадренокортицизм, ХБП — хроническая болезнь почек, НПВС — нестероидные противовоспалительные препараты, ГКС — глюкокортикостероиды.
Цистит — наиболее распространенная патология нижних отделов мочевыводящих путей. В своей практике ветеринарный врач встречается с различными формами циститов: поверхностными, интерстициальными, полипоидными, эмфизематозными, некротизирующими и другими.
Чаще всего у собак и кошек возникают бактериальный цистит, стерильный интерстициальный (идиопатический) цистит и контактный цистит (обычно на фоне присутствия уролитов в мочевом пузыре). Наиболее опасными считаются бактериальные циститы, так как они могут приводить к самым тяжелым последствиям.
Бактериальный цистит происходит на фоне колонизации бактериями нижних отделов мочевыводящих путей. Организм обладает рядом защитных механизмов, препятствующих проникновению бактерий в мочевой пузырь и их закреплению на слизистой оболочке (табл. 1). Инфекционный процесс развивается при нарушении одного или нескольких механизмов защиты. В редких случаях высоковирулентные патогены могут преодолевать неповрежденные защитные механизмы.
К нарушению защитных механизмов мочевыводящих путей могут приводить так называемые предрасполагающие факторы, которые делятся на структурные и метаболические.
Факторы риска развития ИМП
Анатомические нарушения мочеполовой системы, предрасполагающие к ИМП:
- Остаточный урахус может являться резервуаром для застойной мочи, иметь поврежденный гликозаминогликановый (ГАГ) слой и содержать микроабсцессы.
- Изменение конфигурации стенки МП. Полипоидный цистит, неоплазия стенки мочевого пузыря или уретры, уролиты могут являться резервуарами для микроорганизмов, где антибиотики часто не могут достичь своей терапевтической концентрации.
Экзогенные кортикостероиды, применяемые у собак:
- Около 40 % собак, получающих длительную кортикостероидную терапию (6 месяцев и более), имеют ИМП.
- Наибольший риск — у сук и кастрированных кобелей.
- Многие пациенты не имеют ярко выраженных клинических проявлений ИМП, осадок мочи может не выявлять признаков наличия воспаления.
- Необходим посев мочи для постановки диагноза.
Эндогенные кортикостероиды у собак (гиперадренокортицизм):
- ИМП возникает у 46 % собак с ГАК.
- Многие пациенты не имеют ярко выраженных клинических проявлений ИМП, осадок мочи может не выявлять признаков наличия воспаления.
- Необходим посев мочи для постановки диагноза.
Кошки с ГАК:
- ИМП развивается примерно у 12 % кошек.
- Рекомендуется посев мочи, так как ИМП часто протекает без ярко выраженных симптомов.
Сахарный диабет:
- ИМП возникает у 37 % собак и у 12 % кошек.
- Многие пациенты не имеют ярко выраженных клинических проявлений ИМП, осадок мочи может не выявлять признаков наличия воспаления.
- Необходим посев мочи для постановки диагноза.
ХБП:
- ИМП развивается примерно у 30 % животных с ХБП, обычно в течение 1 года после постановки диагноза.
- Чаще выделяется E. coli.
- ИМП может быть фактором, способствующим прогрессированию ХБП.
Уролитиаз:
- Результат посева мочи, собранной методом цистоцентеза, может быть отрицательным.
- Бактерии могут локализоваться в стенке мочевого пузыря или на поверхности уролита. Для выявления возбудителя рекомендуется проводить посев слизистой оболочки и/или уролита.
Установленный уретральный катетер:
- Бактерии заносятся в мочевой пузырь во время проведения катетеризации уретры.
- Единичный эпизод катетеризации у сук приводит к ИМП в 20 % случаев в течение первых 3 дней.
- Бактерии могут мигрировать как по просвету катетера, так и между катетером и стенкой уретры, поэтому ИМП может развиваться даже при использовании закрытой системы для сбора мочи.
- Развитие инфекции возрастает в разы при использовании антибиотика одновременно с установленным уретральным катетером. Более того, выделяемые после извлечения катетера бактерии, как правило, оказываются устойчивыми к данному антибактериальному препарату.
Недержание мочи:
- При застое мочи происходит перерастяжение стенок мочевого пузыря, что приводит к ишемии и микроразрывам слизистой оболочки.
- Слабая струя мочи не производит адекватного вымывания бактерий из проксимального отдела уретры.
- Пиодермия вульварных складок становится дополнительным источником инфекции.
Другие факторы:
- Химиотерапия.
- Иммуносупрессия.
- Нарушение защитных механизмов слизистой оболочки.
- Нарушение мочеиспускания.
- Гиперплазия клитора (особенно у грейхаундов).
- Промежностная уретростомия (особенно у собак).
Развитие стерильного интерстициального цистита происходит вследствие гиперактивации нервной системы, что приводит к образованию дефектов на слизистой оболочке мочевого пузыря. Механизм дальнейшего повреждения связан с воздействием высококонцентрированной мочи на стенку мочевого пузыря, не защищенную слизистой оболочкой. Такое воздействие приводит к механическому повреждению стенки, а также к активации нервной системы за счет перераздражения нервных окончаний в месте воздействия, что замыкает патологический круг (рис. 1).
При уролитиазе происходит контактное повреждение слизистой оболочки мочевого пузыря. Постоянное повреждающее воздействие приводит к развитию хронического воспаления, а также может предрасполагать к развитию инфекции вследствие нарушения защитных механизмов мочевого пузыря.
Чтобы разобраться, что происходит при остром воспалении и, что более важно в рамках данной темы, при хронизации данного процесса, нужно вспомнить этапы протекания воспалительной реакции.
Воспаление состоит из нескольких этапов: повреждение, удаление поврежденных тканей и повреждающих агентов, пролиферация (заживление).
После повреждения тканей происходит вазодилатация. В результате замедляется скорость кровотока в участке воспаления, возникает экссудация плазмы, протеина, фибриногена и клеточных элементов в межклеточное пространство. Продукция цитокинов и хемокинов клетками воспаления регулирует силу воспалительного процесса, нейтрофилы осуществляют фагоцитоз и выделение лизосом в экссудат, что приводит к локальному повреждению тканей.
Фаза восстановления начинается в ранний период и заканчивается только после полного устранения воспалительного агента. В эту фазу происходит восстановление базальной мембраны, осуществляется реэпителизация участков с незначительным повреждением тканей, крупные дефекты закрываются соединительной тканью (фиброзируются).
Если в острую фазу не удается устранить источник повреждения тканей, происходит хронизация процесса.
Хроническое воспаление характеризуется протеканием двух конкурентных процессов: клеточной инфильтрацией и фиброплазией в попытке изолировать и элиминировать этиологический фактор.
Если устранить воспаление не удается, этиологический фактор изолируется различными путями, в том числе путем «заключения» в коллаген, продуцируемый фибробластами. Со временем соединительная ткань подвергается разрастанию, развивается фиброз. Таким образом, в мочевом пузыре формируется так называемый гиперпластический цистит, клиническим проявлением которого является образование полипов на стенке пузыря.
В гуманной медицине описано несколько этапов прогрессирования гиперпластического цистита (рис. 2):
- Полипоидный цистит (нормальный или гиперплазированный уротелий, выраженный воспалительный отек собственной пластинки слизистой оболочки).
- Папиллярный цистит или фиброэпителиальный полип (гиперплазия уротелия, выраженный фиброз).
- Буллезный цистит (выраженный отек собственной пластинки).
Также формами гиперпластического цистита являются интерстициальный и фолликулярный циститы (рис. 3).
Интерстициальный цистит развивается при стерильном воспалении мочевого пузыря и характеризуется инфильтрацией собственной пластинки воспалительным экссудатом, изъязвлением и нарушением целостности уротелия.
Фолликулярный цистит является еще одной формой тяжелого бактериального воспаления и характеризуется скоплением лимфоцитов в виде лимфоидных фокусов в слизистом и подслизистом слоях уротелия.
При воздействии крайне агрессивного агента может преобладать фаза повреждения и некроза тканей, что приводит к некрозу слизистой оболочки, а в редких случаях — к некрозу всей стенки мочевого пузыря. Подобным течением нередко характеризуется цистит, вызванный микроорганизмами Corynebacterium urealyticum (рис. 4).
Как правило, коринебактерии заселяются на сильно поврежденную ранее стенку мочевого пузыря, например после длительной бактериальной инфекции, не поддающейся или не подвергавшейся лечению, или у пациента с атонией мочевого пузыря. Частыми осложнениями коринебактериальной инфекции становятся некроз и отслоение слизистой оболочки мочевого пузыря. Также коринебактерии являются уреазопродуцирующими микроорганизмами, поэтому такая инфекция, помимо развития некротизирующего цистита, характеризуется инкрустрацией уротелия с образованием плотных струвитных бляшек на поверхности эпителия, развитием струвитного уролитиаза (рис. 5, 6).
Лечение
Поскольку наиболее важной причиной развития хронического цистита является нарушение защитных механизмов мочевыводящей системы, основной задачей терапии становится их восстановление.
Достигается это в первую очередь за счет устранения основного повреждающего фактора, чего зачастую бывает достаточно при лечении острых циститов. Если же речь идёт о хроническом процессе, важной задачей становится создание условий, при которых восстановление защитных механизмов становится возможным. Это достигается за счет прекращения воздействия повреждающего фактора на достаточное для восстановления время (этим, в частности, обусловливается длительная антибиотикотерапия при лечении хронических уроциститов).
Краеугольным камнем лечения ИМП является антибиотикотерапия. Подбор антибиотика у пациента с хроническим бактериальным уроциститом осуществляется исключительно на основании бактериологического посева мочи, взятой методом цистоцентеза. Антибиотикотерапию проводят от 14 дней до 6 месяцев, иногда дольше, если в ближайшее время после окончания курса антибиотика наблюдался рецидив бактериального уроцистита. В подобном случае наряду с антибиотикотерапией обязательно проводится дополнительная диагностика, направленная на выявление факторов, предрасполагающих к развитию инфекции (структурные аномалии, иммуносупрессия и т. д.).
Необходимо помнить, что при значимом повреждении стенки микрофлора может меняться на устойчивую к применяемому на данный момент антибиотику даже в процессе антибактериального лечения. В связи с этим у хронических пациентов рекомендуется контролировать стерильность мочи как в процессе терапии, так и после ее окончания.
Контроль стерильности мочи при проведении антибиотикотерапии нужно осуществлять:
- через 3-5 дней от начала приема антибиотика;
- ежемесячно во время применения антибиотиков;
- перед окончанием курса антибиотикотерапии;
- через 5-7 дней после окончания антибиотикотерапии.
Основное внимание при лечении хронической ИМП стоит уделять коррекции предрасполагающих факторов — как структурных, так и метаболических.
Для коррекции стерильного гиперпластического цистита применяются стероидные или нестероидные противовоспалительные препараты. Автор статьи в качестве терапии первой линии обычно использует такие НПВС, как Мелоксикам или Робенакоксиб, с длительностью курса 14-21 день. Кортикостероиды применяются автором в случае неэффективности НПВС из-за более выраженных побочных действий ГКС.
При уролитиазе часто достаточной мерой считается удаление уролитов, хотя иногда остаточный гиперпластический цистит требует терапии антибиотиками или противовоспалительными препаратами. Краеугольным камнем терапии при этом является спектральный анализ уролита, позволяющий проводить терапию, направленную на профилактику рецидивирования.
Сложной задачей для клинициста может стать лечение уроцистита, сопровождающегося некрозом слизистой оболочки мочевого пузыря. Многим подобным пациентам необходимо проводить цистотомию с последующим удалением некротизированной и инкрустрированной слизистой оболочки, так как она является резервуаром для инфекции. Не проведенная вовремя операция может привести к рецидивирующей обструкции уретры, а иногда и к тотальному некрозу стенки мочевого пузыря. Однако некоторые пациенты полностью выздоравливают при проведении адекватной антибиотикотерапии. В связи с этим, пожалуй, самой сложной задачей является принятие решения о необходимости проведения цистотомии у пациентов с некрозом слизистой оболочки.
Отдельного внимания заслуживает коринебактериальная инфекция. Данные микроорганизмы часто имеют высокую устойчивость к антибактериальным препаратам. Иногда при подтитровке антибиотиков выявляется отсутствие чувствительности ко всем представленным агентам. В таком случае антибиотиком выбора является ванкомицин, дающий хорошие клинические результаты при лечении инфекции, вызванной Corynebacterium urealyticum.
Поддерживающая терапия
Эффективность поддерживающей терапии при лечении хронических уроциститов является спорной, так как большинство методов не имеет доказанной эффективности. Однако ведение пациентов с тяжелыми рецидивирующими уроциститами нередко становится трудной задачей для врача.
В подобных случаях могут использоваться следующие методы поддерживающей терапии:
- Коррекция предрасполагающих метаболических и структурных нарушений (эпизиопластика при наличии рецессии вульвы у сук).
- Избегание (по возможности) катетеризаций уретры, проведения уретростомии у собак.
- Увеличение объема потребляемой животным жидкости.
- Закисляющие препараты (экстракт клюквы).
- Пробиотики.
- Омега жирные кислоты.
- D-манноза.
- Обработка наружных половых органов растворами антисептиков.
Результаты лечения:
- Разрешение клинических признаков, посев мочи стерильный. Так происходит в большинстве случаев.
- Клинические признаки разрешаются, а затем возвращаются. Положительный посев мочи:
- А. Реинфекция, новые бактерии (инфекция по причине нарушения защитных механизмов).
- Б. Рецидив или хроническая инфекция:
- Та же бактерия с той же чувствительностью (антибиотик неэффективен):
- Организмы могут сохраняться в биопленках.
- Антибиотики не достигают микроорганизмов.
- Те же организмы с приобретенной устойчивостью.
- В. Суперинфекция — предыдущие организмы уничтожены, но появились новые.
- Клинические признаки сохраняются (с положительным или отрицательным культивированием):
- А. Неверный диагноз (стерильное воспаление).
- Б. ИМП наслоилась на новообразование.
- В. Суперинфекция.
Список литературы:
- Bartges J., Polzin D. J. Nephrology and Urology of Small Animals, 2011.
- Chow D. J., Dibatola S. P., Schenck P. Canine and feline nephrology and urology, 2011.
- Aughey E., Frye F. L. Comparative Veterinary Histology with Clinical Correlates, 2001.
- Eurell J. A., Frappier B. L. Dellmann’s Textbook of Veterinary Histology, 6th Edition, 2006.
- Bacha W., Bacha L. Color Atlas of Veterinary Histology, 2nd Edition, 2000.
- Grauer G. F. Current thoughts on pathophysiology and treatment of feline idiopathic cystitis, 2013.
- Brooks C. W. The pet health library. Feline idiopathic cystitis, 2009.
- Martinez I., Mattoon J. S., Eaton K. A., Chew D. J., DiBartola S. P. Polypoid cystitis in 17 dogs (1978-2001). J Vet Intern Med, 2003.
- Ruiz G., et al. Polypoid cystitis in a male entire springer spaniel puppy. Vet Rec Case Rep, 2018.
- Humphrey P. A. Polypoid/papillary cystitis. J Urol, 2013.
- Patrick D. J., Fitzgerald S. D., et al. Classification of Canine Urinary Bladder Urothelial Tumours Based on the World Health Organization/International Society of Urological Pathology Consensus Classification. J Comp Path, 2006.
- Galemore E., Labato M. A. Recurrent Hematuria in a Dog. Clin Brief, 2016.
- Sul R. M., Hammond G., Pratschke K. Follicular cystitis in a dog. Vet Rec Case Rep, 2014.
- Fuentealba I. C., Illanes O. G. Eosinophilic cystitis in 3 dogs. Can Vet J Volume, 2000.
- Ozaki K., Nakahara Y., Narama I. Polypoid Eosinophilic Cystitis with Pseudosarcomatous Proliferative Tissue in a Dog. J Vet Med Sci, 2008.
- Salem N., Salem L., et al. Corynebacterium urealyticum: a comprehensive review of an undered organism. Infect Drug Resist, 2015.
- Weese J. S., Blondeau J., et al. International Society for Companion Animal Infectious Diseases (ISCAID) guidelines for the diagnosis and management of bacterial urinary tract infections in dogs and cats. The Veterinary Journal, 2019.
Источник