Опухоли мочевого пузыря литература
Содержание статьи
Рекомендуемая литература по теме «Опухоли почек и мочевого пузыря»
1. Косинец А.Н., Жебентяев А.А. Почечно-клеточный рак. — Витебск, 2002. — 131с.
2. Нечипоренко Н.А., Батвинков Н.И. Урология (Учебное пособие для студентов). — Гродно, 2005. — 187с.
3. Приказ №80 от 09.02.2007г. Об утверждении клинических протоколов «Алгоритмы диагностики и лечения больных злокачественными новообразованиями». — Минск, 2007. — 512с.
4. Савченко Н.Е., Нечипоренко Н.А. Учебно-методическое пособие по урологии. — Минск, 2000. — 239с.
5. Филиппович В.А. Лекции по урологии. (Пособие для студентов лечебного и медико-психологического факультетов). — Гродно, 2008. — 210с.
Глава 5. Доброкачественная гиперплазия и рак предстательной железы доброкачественная гиперплазия предстательной железы
Анатомия и физиология предстательной железы. Предстательная железа (простата) является органом мужской половой системы, располагается в полости малого таза непосредственно под мочевым пузырем и охватывает часть задней уретры.
Паренхима простаты состоит из железистых структур и стромы, содержащей фиброзную ткань и волокна гладких мышц. Структура простаты в разных ее отделах не одинакова. В простате различают 4 зоны, которые отличаются друг от друга морфологическими признаками и своей функцией: переходная, центральная, периферическая и передняя фиброзно-мышечная строма(рис. 5-1). В силу морфологических и функциональных различий в этих зонах развиваются разные патологические процессы.

Рис. 5-1. Схема зонального строения предстательной железы
В периферической зоне развивается рак предстательной железы (РПЖ), в переходной — доброкачественная гиперплазия (ДГПЖ).
В железах простаты продуцируется секрет, который имеет слабо кислую реакцию. Секрет входит в состав спермы и составляет около 15-25% объема эякулята. Секрет простаты содержит фруктозу, которая является источником энергии для сперматозоидов, секрет семенных пузырьков, лимонную кислоту, обеспечивающую необходимый рН и осмолярность, а также цинк. Простата выделяет также полиамины необходимые для синтеза ДНК, и простагландины, которые стимулируют подвижность сперматозоидов. Секрет простаты содержит некоторые иммуноглобулины, а также обеспечивает снижение вязкости спермы за счет наличия активаторов плазминогена и простат-специфического антигена (ПСА).
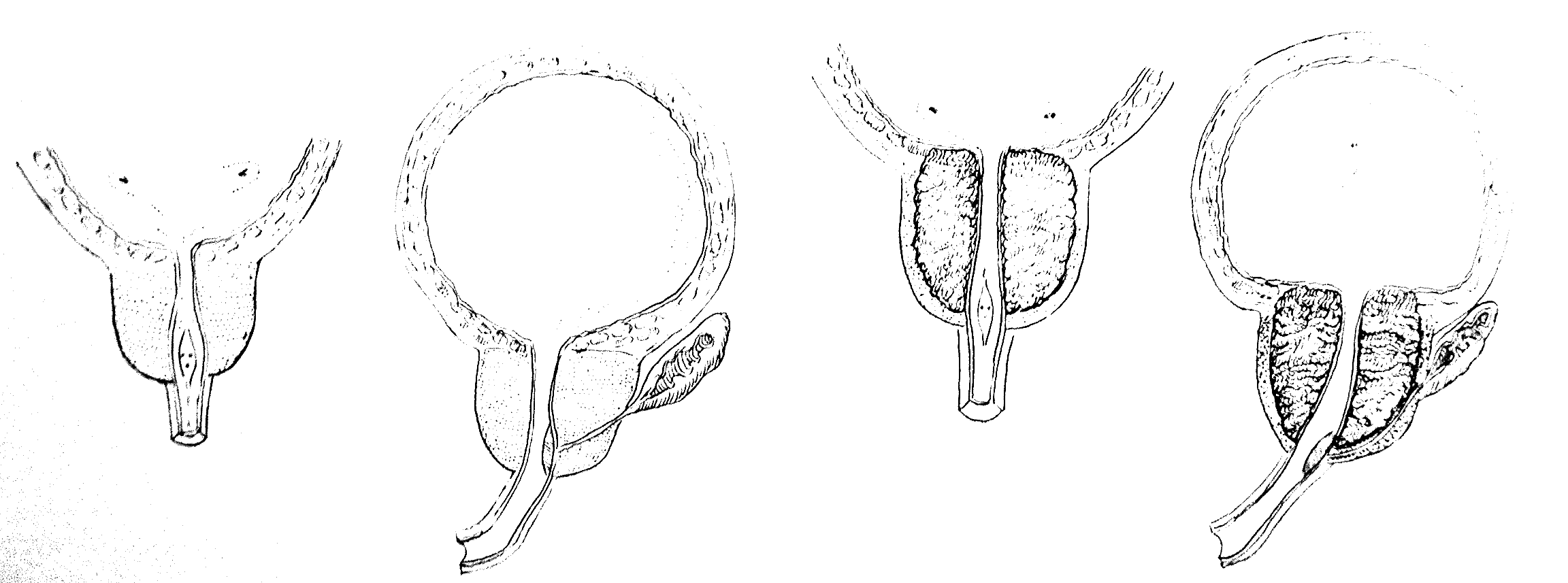
ДГПЖ представляет собой разрастание железистых структур и стромы в переходной зоне простаты. Разрастание переходной зоны простаты приводит к появлению боковых долей ДГПЖ, а разрастание центральной зоны — «средней доли». Периферическая зона и передняя фиброзно-мышечная строма отодвигаются к периферии увеличивающейся гиперплазированной тканью, атрофируются и образуют хирургическую капсулу ДГПЖ. (рис. 5-2).

а б
Рис. 5-2. Схема развития доброкачественной гиперплазии простаты:
а — аденоматозная гиперплазия отсутствует; б — замещение простаты гиперплазированной тканью, ткань простаты превращается в хирургическую капсулу аденомы
Эпидемиология
ДГПЖ развивается практически у всех мужчин преклонного возраста. У 50% мужчин в возрасте 60 лет и у 80% в возрасте 80 лет гистологически обнаруживается ДГПЖ. Отмечено, что клинические проявления ДГПЖ имеют место у 30% мужчин в возрасте 50 лет и старше.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Рак мочевого пузыря
Опухоли мочевого пузыря могут быть доброкачественными (папилломы) и злокачественными (папиллярный и инфильтрирующий рак). Папиллома — мягкая опухоль на тонкой ножке, состоящая из множества длинных ветвящихся ворсинок. Папилломы могут злокачественно перерождаться и подлежат хирургическому удалению в ходе эндоскопических (выполняются без дополнительных разрезов) операций, несмотря на свою доброкачественную природу.
Надо сказать, что доброкачественные новообразования в мочевом пузыре встречаются относительно редко — не более чем в 10% случаев. Злокачественное поражение мочевого пузыря — довольно часто встречающаяся онкоурологическая проблема. У мужчин это заболевание выявляется в 4 раза чаще, чем у женщин. Опухоли мочевого пузыря составляют 1,5-3% от общего числа злокачественных опухолей и 30-50% — от опухолей мочеполовых органов. Наиболее часто эта форма опухоли встречается в возрасте 40-60 лет. По распространенности рак мочевого пузыря (РМП) занимает 4-е место среди всех злокачественных новообразований у мужчин и 9-е место — у женщин. Мочевой пузырь ввиду анатомических особенностей строения, расположения и функций чаще всего подвержен различным поражениям. Данное утверждение обусловлено прежде всего накапливающей функцией мочевого пузыря, и те продукты, которые находятся в растворенном состоянии в моче, способны действовать пролонгированно на стенку мочевого пузыря, чего не скажешь, например, о стенке мочеиспускательного канала.
Причины возникновения РМП
Однозначно утверждать, что причины возникновения опухолей мочевого пузыря изучены досконально, нельзя, но кое-что об истоках этого заболевания известно. Так, однозначно доказана связь риска развития РМП с курением табака, а также с действием некоторых химических и биологических канцерогенов. Курильщики сталкиваются с этим заболеванием до 6 раз чаще, чем больные, у которых этой пагубной привычки нет. Промышленные канцерогены, используемые в резиновом, лакокрасочном, бумажном и химическом производстве, часто являются причиной возникновения РМП. Широко известно вредное влияние анилина. Так, у рабочих, занятых в анилиновом производстве, значительно чаще наблюдался РМП, чем у других групп населения, причем иногда опухоли возникали через 10 лет после прекращения контакта с анилином. Механизм воздействия канцерогенов на стенку мочевого пузыря очевиден — выделяясь с мочой, они контактируют со слизистой оболочкой. Именно поэтому стандартные меры профилактики злокачественных образований мочевого пузыря начинаются с соблюдения норм потребления жидкости (около 1,5-2 л/сут) и своевременного опорожнения мочевого пузыря при позыве к мочеиспусканию. Надо отметить, что РМП — профессиональное заболевание водителей. Причина этого заключается в том, что не всегда есть возможность опорожнить мочевой пузырь при возникновении позыва, т. к. быстро найти туалет на дороге зачастую не удается.
К факторам риска развития онкологического процесса в мочевом пузыре относится употребление хлорированной воды — риск увеличивается в 2 раза. К пищевым канцерогенам можно отнести жареное мясо и жиры животного происхождения. Продукты питания с высоким содержанием витаминов A, С, калия, â-каротина, пища, приготовленная с использованием растительного масла с высоким содержанием полиненасыщенных жирных кислот, обладают защитным действием.
Дистанционная лучевая терапия, перенесенная ранее больным по поводу другого заболевания (например, рака яичников или рака шейки матки), химиотерапия с использованием циклофосфамида также являются предрасполагающими факторами к развитию новообразований в мочевом пузыре.
Хронический цистит и паразитарная инфекция шистосомоз не исключают попадания пациента в группу риска. Длительное стояние уретрального катетера сегодня также относят к возможным причинам развития РМП у определенной группы урологических больных.
Симптомы РМП
Первым проявлением РМП чаще всего становится примесь крови в моче. Так бывает в 75% случаев. В большинстве случаев примесь крови не сопровождается никакими болевыми ощущениями, может быть длительной или кратковременной, интенсивной или едва заметной, но она всегда должна вызвать беспокойство и стать причиной немедленного обращения к врачу. Появление примеси крови в моче может повторяться через различные промежутки времени. Этот симптом не всегда однозначно свидетельствует о злокачественном поражении, он может быть следствием инфекции и развития цистита, особенно если имеется сопутствующее учащенное болезненное мочеиспускание. Если опухоль прорастает глубоко в стенку пузыря, то возможны грозные осложнения: сдавление мочеточников с развитием почечной недостаточности, прорастание опухоли в кишечник или влагалище с развитием мочепузырно-кишечных или мочепузырно-влагалищных свищей, развитие острой или хронической анемии вследствие внутрипузырного кровотечения. На этом этапе больных начинают беспокоить боли в поясничной области. По статистике, 75% всех впервые выявляемых опухолей носят поверхностный характер и не проникают глубоко в стенку мочевого пузыря.
При прогрессировании заболевания наблюдается возникновение других симптомов, таких как затрудненное болезненное мочеиспускание, к которому присоединяются болевые ощущения в нижних отделах живота, промежности, крестце и в паховых областях; императивные позывы к мочеиспусканию. Первоначально боли наблюдаются только при наполнении мочевого пузыря, а немного позднее становятся постоянными, изнуряющими. Степень прорастания опухолью стенки мочевого пузыря и интенсивность болевых ощущений имеют прямо пропорциональную зависимость.
Диагностика
Установление диагноза РМП с определением онкологической распространенности процесса и стадии заболевания предполагает проведение комплексного обследования, включающего в себя осмотр, пальпацию, проведение инструментальных и лабораторных методов исследования. При обращении к врачу обследование начинается с осмотра и пальпации, но растущие внутрь пузыря небольшие опухоли обычно не прощупываются. Пальпируемое образование свидетельствует о распространенном проникающем поражении пузыря.
К лабораторным методам исследования относятся:
• общий анализ мочи (обнаружение эритроцитов в осадке мочи);
• бактериологический посев мочи (для исключения инфекции мочевыводящих путей);
• анализ на онкомаркеры (определение в крови и моче пациента специальных антигенов или РНК);
• биохимический анализ крови (определение уровня азотистых оснований).
К инструментальным методам исследования относятся:
• УЗИ (ультразвуковое исследование) — наиболее доступный и информативный метод первичной диагностики опухоли мочевого пузыря, является скрининг-методом в обследовании урологических больных с подозрением на новообразования в органах мочевыводящей системы. Проводится исключительно при наполненном мочевом пузыре. При УЗИ обнаруживается большинство опухолей размером более 1 см.
• МРТ (магнитно-резонансная томография) и МСКТ (мультиспиральная компьютерная томография) с контрастированием позволяют установить стадию заболевания и глубину поражения стенки мочевого пузыря, вовлечение регионарных лимфатических узлов.
• Цистоскопия (осмотр мочевого пузыря с помощью эндоскопических инструментов, которые проводятся по мочеиспускательному каналу в просвет мочевого пузыря). Данный метод диагностики позволяет определить локализацию, размер, количество новообразований, а также характер их роста. При осмотре оценить степень их злокачественности и гистологическое строение невозможно, т. к. подавляющее большинство новообразований мочевого пузыря дают схожую эндоскопическую картину.
• Биопсия с последующим гистологическим исследованием материала проводится для установления окончательного диагноза.
• Радиологическое исследование и рентгенография грудной клетки используются при подтвержденном диагнозе РМП для определения метастатического поражения костей скелета и легких.
Лечение РМП
Лечение включает различные оперативные вмешательства, лучевую и лекарственную терапию. Выбор оптимальной тактики ведения больного зависит от стадии заболевания. Подход к лечению РМП с признаками прорастания опухоли в мышечный слой мочевого пузыря и без таковых принципиально разный.
В 75% случаев мышечный слой не поражен. Раньше такие опухоли называли «поверхностными», сейчас — «мышечно-неинвазивными» (рис. 1). Это стадии заболевания Та и Т1. Прогноз лечения у таких пациентов — более благоприятный. Стандарт лечения подобных опухолей при отсутствии метастазов — трансуретральная резекция (эндоскопическая операция, подразумевающая электрорезекцию зоны мочевого пузыря с опухолевым поражением) с последующим проведением иммуно- или химиотерапии. Необходимость последующей терапии объясняется тем, что около 70-80% опухолей мочевого пузыря склонны к рецидивированию в течение последующих 5 лет после операции. Проведение специфического лечения, заключающегося в периодическом введении препаратов в мочевой пузырь по определенной схеме, позволяет снизить риск рецидивирования до 20-35%.
Если диагноз злокачественного поражения не подтвердился или опухоль проникает в мышечный слой, то внутрипузырная терапия не назначается. В этом случае может обсуждаться выполнение курса лучевой терапии или более радикальное оперативное вмешательство, направленное на полное удаление пораженного опухолью органа с последующим созданием мочевого пузыря из сегмента тонкой или толстой кишки.
Резекция мочевого пузыря как метод лечения инвазивного РМП сегодня практически не используется ввиду частого рецидивирования и метастазирования. В некоторых случаях, особенно за рубежом, применяется лучевая терапия в дозе 60-70 Гр, самостоятельно или как дополнение к оперативному лечению. Предоперационное проведение лучевой терапии способствует уменьшению самой опухоли и перифокальных воспалительных изменений, что значительно облегчает оперативное вмешательство, а иногда делает неоперабельную опухоль операбельной. Проведение послеоперационной лучевой терапии показано в случае недостаточно радикально выполненного вмешательства, а также для профилактики рецидивов. В дополнение к лучевой терапии у пациентов с наличием метастатического поражения других органов и систем возможно использование системной химиотерапии.
Радикальная цистэктомия — метод выбора в лечении глубоко инфильтрирующих опухолей. Она включает удаление мочевого пузыря и простаты у мужчин; мочевого пузыря, уретры, передней стенки влагалища и матки — у женщин. В случае распространенного поражения (уретра, матка, простата) возможность применения эндоскопических операций практически исключена. Иногда последний этап операции (создание мочевого пузыря из сегмента кишки) откладывается на некоторое время. Это позволяет минимизировать объем операции у ослабленных больных на запущенных стадиях рака. В таких случаях используется методика выведения мочеточников на кожу.
При распространенном раке, вовлечении забрюшинных лимфатических узлов, отдаленных метастазах основное значение имеет химиотерапия. Рецидивы опухоли могут возникать как после лучевого лечения, так и после хирургических вмешательств и подлежат паллиативному облучению или симптоматической терапии.
Прогноз зависит от стадии процесса и характера проведенного лечения. После радикальной операции 5-летняя выживаемость составляет около 50%. Наилучшие результаты наблюдают при комбинированном лечении (резекция мочевого пузыря с лучевой терапией). При стадиях Т1-2 5-летняя выживаемость составляет 50-80%, стадиях Т3-4 — 20-30%. При поверхностном поражении мочевого пузыря на стадии Та 10-летняя выживаемость достигает 87%. Раннее выявление и адекватное лечение РМП — залог успеха!
Источник
Медицинские интернет-конференции
Рак мочевого пузыря занимает второе место среди онкоурологических заболеваний в России и третье по смертности от них. Заболеваемость РМП постоянно растет. В течение последних 10 лет прирост больных раком мочевого пузыря в России составил 58,6% [1]. В США рак мочевого пузыря занимает пятое место среди всех видов рака (1,6 %) [2, 3]. Вместе с тем своевременная диагностика опухолей мочевого пузыря и лечение больных с данной патологией остаются сложными и актуальными проблемами современной онкологии.
Клиническая классификация рака мочевого пузыря строится с учетом важнейших биологических особенностей опухолей из уротелия. Исходя из характерной для переходноклеточной карциномы мультицентричности очагов поражения, в классификации предусмотрено введение индекса (m), добавление которого к символу Т свидетельствует о множественности опухолей. Классификация содержит рубрики, характеризующие неинвазивную папиллярную карциному (Та) и интраэпителиальный рак или «плоскую опухоль» — карциному in situ — (Tis) [4].
Разделение новообразований мочевого пузыря на две группы — мышечнонеинвазивные и мышечноинвазивные — имеет принципиальное значение [5]. Уточнение глубины инвазии является важным аспектом диагностического процесса и часто представляет трудную задачу, как для клинициста, так и для патоморфолога. Символы Т2 — Т4 указывают на поражение мышечных слоев стенки (поверхностного и глубокого), а также на вовлечение в процесс околопузырных тканей и прилежащих органов. Помимо характеристики первичной опухоли (Т), клиническая классификация предусматривает информацию о регионарных (N) и отдаленных (М) метастазах [4].
Установление стадии инвазии рака мочевого пузыря является важнейшим аспектом диагностики, поскольку именно этот показатель определяет выбор тактики хирургического лечения и прогноз заболевания для пациента. При правильно установленной стадии инвазии, в Та — Т1 стадиях РМП трансуретральная резекция опухоли мочевого пузыря дает хорошие результаты и позволяет достичь пятилетней выживаемости у 85-94% пациентов. Послеоперационная летальность при данном виде хирургического лечения рака мочевого пузыря равна нулю, общее количество осложнений составляет около 18%, среди которых кровотечение (6,3%), внутрибрюшинная перфорация (0,5%), стриктура уретры (7,8%). У большинства больных полностью восстанавливается трудоспособность [6].
В связи с этим правильность установления стадии инвазии рака мочевого пузыря на дооперационном этапе является исключительно важной задачей. Несоответствие выбранного вида оперативного лечения степени инвазии опухоли приводит, с одной стороны, к несоблюдению радикальности, с другой стороны, к использованию необоснованной по объёму и тяжести хирургической операции.
Ведущую роль в установлении диагноза рака мочевого пузыря, как и много десятилетий тому назад, продолжает играть цистоскопия [7]. Важным аспектом использования цистоскопии является обеспечение визуального контроля за выполнением биопсии мочевого пузыря. Однако, по данным цистоскопии нельзя определить стадию заболевания, особенно затруднительно при дифференциальной диагностике между Т1 и Т2 стадиями. В последние десятилетия ведётся интенсивный поиск опухолевых маркеров рака мочевого пузыря, обнаружение которых в моче можно было бы рассматривать как показание для проведения цистоскопии [7].
В настоящее время в комплекс методов лучевой диагностики при РМП входят: ультразвуковое исследование, рентгенологические методики, рентгеновская компьютерная томография, магнитно-резонансная томография.
Одним из общепринятых неинвазивных и информативных методов является ультразвуковая диагностика. Ультразвуковое исследование мочевого пузыря проводится через переднюю брюшную стенку (трасабдоминально) или с применением внутриполостных высокочастотных датчиков (трансректально, трансвагинально и трансуретрально). Трансуретральное ультразвуковое сканирование мочевого пузыря является наиболее достоверным методом, особенно для определения глубины инвазии стенки пузыря, рака in situ и степени истончения стенки пузыря после трансуретральной резекции мочевого пузыря [8]. По данным В.Н. Шолохова (2000) данная методика имеет точность 82% при опухолях мочевого пузыря >0,5 см и 38% при опухолях <0,5 см В отношении стадии Т1-2 рака мочевого пузыря точность метода составила 55, Т3-83 и Т4-100%. Общая точность оценки стадий не превышает 67% [8]. Также, многие авторы считают ТРУЗИ — лучшим диагностическим инструментом для уточнения возникновения рецидивов РМП особенно после цистэктомии [9].
При выполнении экскреторной урографии с нисходящей цистографией можно получить представление о локализации и размерах образования при экзофитном росте, емкости мочевого пузыря и состоянии верхних мочевыводящих путей. Уменьшение емкости мочевого пузыря, появление уретеропиелоэктазии свидетельствует в пользу инвазивного РМП. При опухоли лоханки почки на экскреторной урограмме виден дефект наполнения лоханки и мочеточника, гидронефроз, могут не контрастироваться верхние мочевые пути на стороне поражения [10]. Нарушение пассажа мочи (локализация в области шейки мочевого пузыря и уретральных устьев) выявляется при экскреторной урографии в 95% [11].
Рентгеновская компьютерная томография (РКТ) как одна из разновидностей рентгенологического метода исследования занимает одно из ведущих мест в диагностике РМП. Некоторые авторы [12] отмечают высокий уровень чувствительности метода — до 80%. Другие авторы указывают на низкую эффективность применения компьютерной томографии при появлении инвазивного компонента опухоли — до 35%. По мнению многих исследователей, использование КТ эффективно: 1) при поражении регионарных лимфатических узлов — точность до 97% [13]; 2) при распространении процесса на соседние органы — точность до 87% [14]; 3) при выявлении опухолей Т3а-Т3б, когда есть возможность оценить толщину и плотность стенки мочевого пузыря, так как отсутствие четкости между наружным контуром стенки пузыря и паравезикальной клетчаткой является признаком внепузырной инфильтрации [15]. Болюсная РКТ — урография в комплексе с нативной РКТ позволяет получить наиболее полную лучевую информацию о состоянии всего мочевого тракта [16].
Применение магнитно-резонансной томографии (МРТ) существенно упростило проблему диагностики рака мочевого пузыря [17]. МРТ может помочь в разграничении инвазивной и неинвазивной форм рака мочевого пузыря, позволяет уточнить распространенность опухоли и вовлеченность в процесс окружающих органов. При необходимости оценки инвазивного компонента опухоли используется внутривенное динамическое контрастное усиление препаратами гадолиния. При динамическом контрастном усилении повышается интенсивность магнитно-резонансного сигнала от опухолевой ткани. Мышечный слой стенки мочевого пузыря дольше чем ткань опухоли остается гипоинтенсивным, темным (на Т1- и Т2-ВИ).
При использовании контрастного усиления возрастает точность диагностического исследования при определении минимального роста опухоли в послеоперационном периоде.
Было отмечено, что применение МРТ при инвазивных формах рака мочевого пузыря позволяет более точно, чем РКТ, УЗИ и цистоскопия, определить прорастание глубокого мышечного слоя мочевого пузыря и вовлечение околопузырной клетчатки [18].
Заключение. Таким образом, констатация наличия опухоли в мочевом пузыре — это необходимое, но совершенно недостаточное условие для планирования адекватного лечения. Комплекс диагностических мер должен обеспечивать максимально полную информацию о гистологической структуре, уровне дифференцировки, анатомической форме роста опухоли, о глубине инвазии стенки мочевого пузыря, наличии регионарных и/или отдалённых метастазов. Кроме того, важно знать, является опухоль одиночной или имеется несколько новообразований в мочевом пузыре. Необходимо отчетливо представлять внутрипузырную локализацию опухолей, особенно их отношение к шейке мочевого пузыря, устьям мочеточников и треугольнику Льето. Обязательно следует исключить наличие синхронных новообразований из уротелия в других отделах мочевыводящих путей — лоханках, мочеточниках, уретре.
Несмотря на развитие новых методик лучевой диагностики, по мнению подавляющего большинства авторов, в настоящее время, и в России и в мире проблема ранней диагностики первичной и рецидивной опухоли, определение стадийности РМП, а значит и прогнозирования исходов лечения больных уротелиальной карциномой остается актуальной.
Источник