Обструкция шейки мочевого пузыря лечение
Содержание статьи
СклеÑоз Ñейки моÑевого пÑзÑÑÑ
Склероз шейки мочевого пузыря — это рубцовая деформация уретро-везикального перехода, обусловленная травматическими воздействиями, воспалительными процессами. Проявляется затруднением мочеиспускания, вялостью струи мочи, дизурическими явлениями. Диагностируется при помощи урофлоуметрии, ретроградной и микционной уретрографии, УЗИ мочевыводящих органов, МСКТ цистоуретрографии, задней уретроскопии, цистоскопии. Лечится оперативно путем трансуретральной резекции склерозированного участка. Хирургическое вмешательство дополняют антибактериальной и противовоспалительной терапией, при выраженной обструкции или обтурации предваряют эпицистостомией.
Общие сведения
По результатам исследований в сфере клинической урологии, склеротическая деформация с сужением просвета мочепузырно-уретрального сегмента выявляется у 0,4-1,5% пациентов, перенесших операцию по поводу доброкачественной гиперплазии простаты. Менее распространены случаи заболевания, обусловленные другими причинами. Вероятность развития склероза зависит от способа выполнения аденомэктомии. Реже всего рубцовая деформация возникает после ТУР гольмиевым лазером и биполярной плазменно-кинетической резекции, чаще всего – после чрезпузырной аденомэктомии. Обычно заболевание диагностируют у мужчин в возрасте после 45 лет, идиопатическая врожденная форма болезни может проявляться даже у младенцев.
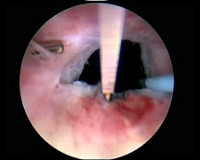
Склероз шейки мочевого пузыря
Причины
Заболевание имеет полиэтиологическую основу, может быть как приобретенным, так и врожденным. Склеротические процессы в области шейки пузыря обычно вторичны, развиваются на фоне другой урологической патологии или под действием различных повреждающих факторов. Непосредственными причинами возникновения склероза в зоне мочепузырного треугольника являются:
- Хирургическое лечение урологических заболеваний. Обычно склеротические изменения выявляются у пациентов, перенесших открытые и эндоскопические операции по поводу аденомы предстательной железы. Реже интенсивное склерозирование начинается после лучевой терапии рака мочевого пузыря или простаты.
- Воспаление органов мочевыделительной системы. Вероятность склероза в области мочепузырно-уретра льного перехода увеличивается при хронических простатитах и циститах. В таких случаях регенеративная фаза воспаления принимает патологический характер, в пораженных участках формируется плотная соединительная ткань.
- Дизэмбриогенез. Идиопатическая форма склероза мочепузырной шейки носит название болезни Мариона. Патология встречается редко, характеризуется кольцевидным фиброзом подслизистого и мускульного слоев на выходе из мочевого пузыря. Факторы, способствующие возникновению врожденного склероза, пока не установлены.
Анатомической предпосылкой к развитию заболевания являются особенности строения стенки пузыря в области мочепузырного треугольника. Соединительная ткань собственной пластинки под уротелием этой зоны отличается меньшей рыхлостью, из-за чего слизистая оболочка менее растяжима и практически не имеет складок. В результате склеротические изменения плохо компенсируются и быстро проявляются клинически.
Патогенез
Механизм склерозирования шейки мочевого пузыря основан на чрезмерном разрастании соединительнотканных элементов при патологической регенерации поврежденных тканей. Как правило, предрасполагающими факторами к появлению склеротических изменений являются нарушение энергетического метаболизма в стенке органа, локальная воспалительная реакция, клеточная дистрофия, микроциркуляторные нарушения, характерные для доброкачественной гиперплазии предстательной железы. Иногда процесс провоцируется действием прямых повреждающих факторов (операционной травмы, лучевого излучения).
Склероз мочепузырной стенки формируется поэтапно. Сначала после фагоцитоза разрушенных клеток и коллагеновых волокон макрофагами в зоне повреждения происходит активная пролиферация фибробластов, усиливается синтез коллагена. В условиях ишемии, посттравматического воспаления, дисциркуляторных явлений нарушается баланс между коллагеногенезом и коллагенолизисом с нарастанием избытка соединительной ткани, преобладанием массы волокон над клеточными элементами, уменьшением количества специализированных клеток. В результате шейка мочевого пузыря подвергается фиброзированию, склерозированию или рубцеванию с частичным сужением (стриктурой) или полным перекрытием (облитерацией) просвета, что проявляется соответствующей клинической картиной.
Симптомы
Основным клиническим признаком заболевания является нарастающее ухудшение оттока мочи вплоть до ее полной острой задержки. На начальных этапах патологического процесса пациенты жалуются на затруднения при мочеиспускании, отмечают вялость мочевой струи. По мере прогрессирования склероза и увеличения количества остаточной мочи в полости органа у больных появляется ощущение неполного опорожнения мочевого пузыря. О присоединении воспаления свидетельствуют частые позывы к мочеиспусканию, болезненное отхождение мочи, повышение температуры тела до субфебрильных цифр.
Осложнения
Нарушение оттока мочи постепенно приводит к увеличению ее остаточного объема и застою в вышерасположенных органах мочевыделительной системы. В крайних случаях расширение мочеточников и чашечно-лоханочной системы завершается развитием двухстороннего уретерогидронефроза и хронической почечной недостаточности. Наличие пузырно-мочеточникового рефлюкса способствует восходящему распространению уроинфекций с возникновением уретерита, пиелонефрита.
На фоне мочепузырного застоя мочи чаще наблюдаются хронические циститы, могут сформироваться микродивертикулы. У некоторых пациентов происходит сморщивание мочевого пузыря. Длительное нарушение мочеиспускания способствует появлению невротических расстройств, депрессии, социальной дезадаптации пациентов.
Диагностика
Обследование мужчин с подозрением на склероз шейки мочевого пузыря включает инструментальные методы, позволяющие выявить признаки сужения участка пузырно-уретрального перехода, исключив другие причины обструкции. Важную роль в диагностическом поиске играет связь патологического процесса с проведенной операцией на простате, лучевой терапией тазовых органов, урологическими инфекциями. Наибольшей информативностью обладают:
- Уродинамические исследования. При сохраненном мочеиспускании пациентам обычно назначают урофлоуметрию. Длительное нарастание и уменьшение объемной скорости тока мочи подтверждает обструкцию нижних отделов мочевыделительной системы, однако не позволяет выявить точное место стеноза. Поэтому методика обычно предваряет проведение других инструментальных исследований.
- Уретрография. Рентгенологический метод дает возможность обнаружить препятствие току мочи в области перехода мочевого пузыря в уретру, при этом уретральный канал остается полностью проходимым. Чаще применяется ретроградная уретрография, визуализирующая заполнение мочеиспускательного канала рентген-контрастным раствором, реже — микционное исследование процесса мочевыделения.
- Эхография. С помощью УЗИ мочевого пузыря оценивают анатомические особенности строения органа, в том числе пузырно-уретрального сегмента, определяют его вместимость и объем остаточной мочи, который при склерозе шейки обычно превышает 20 мл. Дополнительное ультразвуковое исследование почек, мочеточников, простаты (при ее наличии), уретры позволяет установить другие причины нарушения мочеиспускания.
- Мультиспиральная компьютерная томография. МСКТ цистоуретрография, обеспечивающая создание трехмерной модели пораженной области — один из наиболее точных неинвазивных методов диагностики склероза. Используя МСКТ, можно точно определить место стриктуры нижних мочевыводящих путей, выраженность склеротических изменений, толщину стенки везикально-уретрального перехода.
- Эндоскопия. Визуализация пораженной области при уретроцистоскопии дает возможность не только выявить участок стриктуры, но и оценить состояние слизистой оболочки, степень рубцовых изменений. При достаточном для прохождения эндоскопа просвете шейки осматривается полость мочевого пузыря. Обследование может дополняться биопсией для гистологического исследования тканей.
Общий анализ мочи при склерозе мочепузырной шейки играет вспомогательную роль, направлен на выявление возможных сопутствующих воспалительных процессов. Заболевание дифференцируют с аденомой предстательной железы, ложным ходом из мочеиспускательного канала в мочевой пузырь, предпузырем мочевого пузыря, склерозом простаты, злокачественными и доброкачественными опухолями мочевого пузыря. По показаниям врач-уролог может назначить консультацию онколога, андролога.
Лечение склероза шейки мочевого пузыря
Эффективная консервативная терапия заболевания не предложена. Единственный метод восстановления проходимости уретро-везикального сегмента — хирургическое иссечение рубцовой ткани. Эффект от ликвидации стриктуры с помощью бужирования временный, проведение этого вмешательства зачастую приводит к возникновению различных осложнений.
На этапе предоперационной подготовки и в послеоперационном периоде пациенту проводится антибактериальная терапия для профилактики инфекционных осложнений. При наличии признаков воспаления и болевого синдрома возможно дополнительное назначение нестероидных противовоспалительных средств. Для быстрой разгрузки мочевыделительной системы при значительной обструкции шейки предварительно может выполняться открытая или троакарная эпицистостомия.
Наиболее эффективным и наименее травматичным вмешательством для восстановления нормального пассажа мочи является ТУР шейки мочевого пузыря. При трансуретральной резекции склерозированные ткани полностью удаляются лазерными либо электрокоагуляционными ножами, что позволяет устранить обструкцию. Открытые инвазивные операции на мочепузырной шейке из-за травматичности и высокого риска осложнений в настоящее время практически не применяются.
Прогноз и профилактика
Эффективность хирургического лечения склеротической деформации мочепузырной шейки достигает 91%, однако при значительном сужении ее просвета возрастает риск послеоперационных рецидивов. Профилактика склероза направлена на адекватную своевременную терапию урологических заболеваний, щадящее выполнение аденомэктомии, других вмешательств на простате и мочевом пузыре. Для предотвращения рецидива обструкции после ТУР рекомендовано использование современных высокоэнергетичных генераторов, работающих в режиме менее травматичного биполярного резания и коагуляции.
Источник
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.

Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
Источник