Мочевой пузырь при раке предстательной железы
Содержание статьи
Рак мочевого пузыря
Злокачественная опухоль или рак мочевого пузыря — это опасное, а зачастую и смертельное новообразование, изначально исходящее из слизистой мочевого пузыря, способное поразить как располагающиеся рядом с мочевым пузырем органы (предстательную железу, мочеиспускательный канал, матку, прямую кишку), так и отдаленные (легкие, печень, кости, головной мозг).
Злокачественные опухоли мочевого пузыря, классификация, стадии
В зависимости от вида клеток, из которых происходит опухоль, выделяют разные типы рака мочевого пузыря. Наиболее распространена уротелиальная, или переходно-клеточная, карцинома. Она встречается в 90-95% случаев. Гораздо реже опухоль представляет собой аденокарциному, плоскоклеточный рак, мелкоклеточную карциному, саркому (злокачественную опухоль из соединительной ткани).
Стадии рака мочевого пузыря:
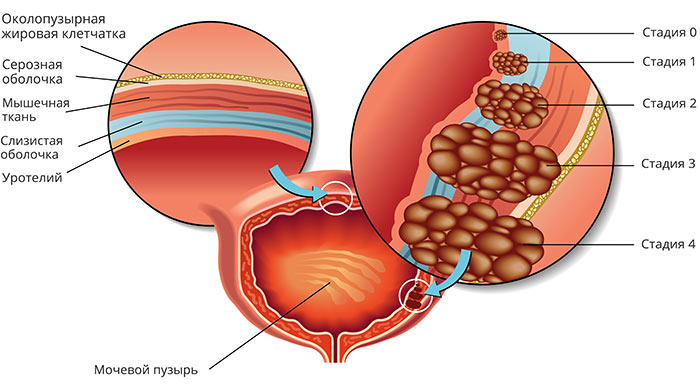
- I — опухоль находится в пределах уротелия (слизистой оболочки) и не прорастает глубже.
- II -опухоль проросла глубже в стенку мочевого пузыря, но все еще не прорастает за его пределы.
- III — опухоль проросла за пределы мочевого пузыря и распространилась на окружающие ткани.
- IV — рак мочевого пузыря с метастазами.
Причины рака мочевого пузыря, факторы риска
Известно, что существуют факторы, которые повышают риск онкологии мочевого пузыря. На некоторые из них можно повлиять, на другие (такие как наследственность и возраст) нельзя:
- Самый значимый фактор риска — курение. У курильщиков заболевание возникает в три раза чаще, чем у некурящих людей. Считается, что примерно половина случаев рака мочевого пузыря у мужчин и женщин связана с курением. Табачный дым содержит токсичные вещества, которые попадают в кровь и выделяются вместе с мочой. Они задерживаются в мочевом пузыре и вызывают злокачественное перерождение клеток слизистой оболочки.
- Некоторые профессии предполагают контакт с вредными веществами, которые повышают вероятность возникновения злокачественных опухолей мочевого пузыря. В группе повышенного риска работники предприятий, которые занимаются производством красителей (воздействие бензидина и бета-нафтиламина), резиновой, кожевенной, текстильной, лакокрасочной продукции, художники, машинисты, парикмахеры (воздействие веществ, которые входят в состав красок для волос), водители грузовиков (воздействие продуктов сгорания дизельного топлива).
- Было замечено, что раком мочевого пузыря реже страдают люди, которые пьют много жидкости. Вероятно, причина в том, что мочевой пузырь у них регулярно очищается.
- Чаще всего заболевание диагностируют в старшем возрасте. Более 90% пациентов с раком мочевого пузыря — люди старше 55 лет.
- У мужчин риски выше, чем у женщин.
Как избежать рака мочевого пузыря? На что обратить внимание?
- Извечный совет всех врачей — не курите. Не курите вообще.
- Частный совет онкоуролога: убедитесь, что вы не используете бензидиновых красителей в творчестве.
- Не задерживайте мочу, лучше посетить туалет каждые 2-3 часа, чем мочиться раз в день.
- И если вдруг в моче показалась кровь, даже капелька, то срочно, в этот же день — к урологу.
Особенно опасно появление крови в моче без боли, жжения и учащения мочеиспускания. Чаще всего это означает, что кровотечение происходит из опухоли мочевого пузыря. Также важным является ежегодная диспансеризация у уролога: УЗИ почек и мочевого пузыря, особенно для тех, у кого родственники болели раком мочевого пузыря.
Что делать, если у близкого человека выявили опухоль мочевого пузыря?
На приём к онкоурологу. Максимально возможно — быстро. Онкоуролог выполнит ряд диагностических процедур и предложит тот или иной вариант лечения. Важно понимать, что способы лечения рака мочевого пузыря разных стадий имеют кардинальные отличия. И чем раньше опухоль выявлена, тем больше шансов, что лечение будет радикальным. Не относитесь равнодушно к появлению даже слабого красного окрашивания в моче, это может иметь самые печальные последствия.
Симптомы злокачественных опухолей мочевого пузыря
Чаще всего признаки злокачественных опухолей мочевого пузыря неспецифичны, в большинстве случаев они бывают вызваны другими заболеваниями. Установить точный диагноз можно только после обследования.

Обычно первый признак рака мочевого пузыря — примеси крови в моче. Они могут окрашивать мочу в оранжевый, розовый, темно-красный цвет. Кровь может появиться один раз, а потом моча несколько недель или месяцев снова выглядит нормально.
Другие возможные симптомы:
- Частые мочеиспускания.
- Боли, рези во время мочеиспусканий.
- Затруднение во время мочеиспускания, слабая струя мочи.
При запущенном злокачественном образовании мочевого пузыря возникают такие симптомы, как боли в пояснице, невозможность помочиться, постоянная слабость и усталость, снижение аппетита и потеря веса, боли в костях, отеки на ногах.
Многие из симптомов, перечисленных выше, возникают при аденоме простаты у мужчин, мочекаменной болезни, отеке слизистой оболочки мочевого пузыря при цистите и других заболеваниях.
Особенности и симптомы рака мочевого пузыря у женщин
Несмотря на различия в строении женской и мужской мочеполовой системы, признаки рака мочевого пузыря у женщин и мужчин не различаются. Есть только один небольшой нюанс: женщины чаще игнорируют кровь в моче, особенно если она появилась незадолго до месячных или во время них. Из-за этого они позже обращаются к врачу.
Некоторые факты:
- Женщины страдают злокачественными опухолями мочевого пузыря реже, чем мужчины.
- Шансы среднестатистической представительницы прекрасного пола заболеть этим онкозаболеванием — 1:88.
- У женщин заболевание обычно диагностируют в более позднем возрасте, чем у мужчин.
- Обычно у женщин обнаруживают менее агрессивные и менее инвазивные опухоли.
- Но если обнаружен запущенный инвазивный рак, шансы выжить у женщины ниже, чем у мужчины.
Особенности рака мочевого пузыря у мужчин
- Мужской пол — фактор риска рака мочевого пузыря. У мужчин заболевание встречается чаще, чем у женщин.
- Шансы мужчины заболеть данной онкопатологией в течение жизни — 1:26.
- У мужчин рак мочевого пузыря обычно диагностируют в более раннем возрасте, чем у женщин, опухоль обычно оказывается более агрессивной и инвазивной.
- У мужчин опухоль может имитировать симптомы аденомы простаты.
Что важно в диагностике рака мочевого пузыря?
Методы диагностики:
- ТУР-биопсия,
- цистоскопия.
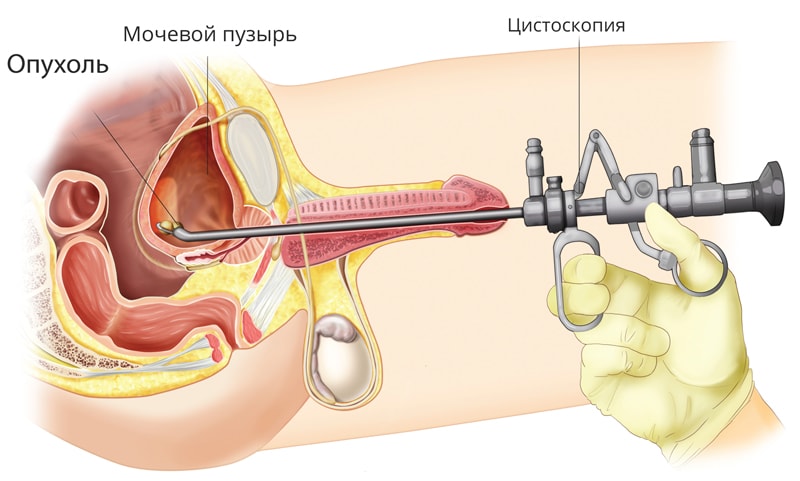
Первое и совершенно необходимое исследование — это цистоскопия. Многие знают про гастроскопию — процедуру осмотра желудка. Практически так же можно определить и цистоскопию — осмотр внутренней поверхности мочевого пузыря.
В Европейской онкологической клинике используются современные цистоскопы Karl Storz и Olympus, процедура выполняется с обезболиванием.
Еще один важный способ диагностики рака мочевого пузыря — ТУР-биопсия. Через мочеиспускательный канал без внешних разрезов вводится специальный инструмент — резектоскоп. Опухоль удаляется в пределах здоровых тканей и отправляется на гистологическое исследование и цитологию мочевого пузыря. И здесь применение фотодинамической диагностики позволяет расширить возможности стадирования: ведь ТУР — это не только диагностика, но в ряде случаев и способ лечения опухоли мочевого пузыря. В синем цвете хирургу видны самые мелкие участки слизистой, пораженных опухолью, для возможности их полного удаления.
Безусловно, важны такие исследования, как компьютерная томография, рентгенография грудной клетки, УЗИ органов брюшной полости. КТ позволяет оценить наличие и размер метастазов, находить пораженные лимфатические узлы, понять, успела ли опухоль выйти за пределы мочевого пузыря и поразить прямую кишку, матку, предстательную железу. Рентгенография грудной клетки делает возможным исключение метастазов в легкие, а УЗИ — в печень.
Методы лечения рака мочевого пузыря
Способ лечения зависит от стадии рака мочевого пузыря. На первых стадиях возможно сохранение мочевого пузыря, хирургическим способом удаляется только сама опухоль. Как было сказано выше, для этого используется ТУР — трансуретральная резекция — операция без каких-либо разрезов, через мочеиспускательный канал. Резко уменьшает количество рецидивов использование фотодинамической диагностики во время ТУР, ведь врач легко видит все пораженные участки мочевого пузыря. После удаления опухоли мочевого пузыря используется внутрипузырная химиотерапия или иммунотерапия: в мочевой пузырь курсами вливается либо химиопрепарат, активный против опухоли, либо вакцина БЦЖ. Введение противотуберкулезной вакцины БЦЖ при раке мочевого пузыря используется в медицине давно и увеличивает безрецидивную выживаемость больных.
Особым случаем является наличие опухоли мочевого пузыря, которая «сидит» прямо на устье мочеточника. Такая опухоль может блокировать отток мочи из почки. Для восстановления функции почки выполняется пункционная нефростомия — установка специальной трубочки в почку для восстановления оттока мочи.
К сожалению, удаление опухоли устья мочеточника сопряжено с обязательным повреждением этого органа. В Европейской онкологической клинике мы предлагаем удаление подобной опухоли при помощи трансуретральной резекции с сохранением мочеточника. Для этого мы пересаживаем мочеточник в верхнюю часть мочевого пузыря лапароскопическим способом, что позволяет избавить пациента от нефростомы.
Если же мы видим, что опухолей много, что имеются метастазы в местные лимфатические узлы, что опухоль слишком глубоко поражает стенку мочевого пузыря, то здесь необходимо решать вопрос об удалении мочевого пузыря и проведении облучения либо системной химиотерапии.
Необходимо понимать, что удаление мочевого пузыря — цистэктомия — это одна из наиболее сложных операций в урологии. Для обеспечения безопасности пациентов, кому показана цистэктомия, в Европейской онкологической клинике создан хирургический блок, отвечающий стандартам безопасности Израиля. Это мощная анестезиологическая и реанимационная служба, операционный зал, оснащенный самым современным оборудованием, позволяющим минимизировать кровопотерю. В блоке интенсивной терапии происходит круглосуточное врачебное наблюдение послеоперационных больных, постоянно мониторируются функции жизненно важных органов.
Как жить без мочевого пузыря, если онкоуролог рекомендует его удаление?
Самый неприятный вариант — удалили мочевой пузырь, а мочеточники вывели на кожу. У пациента нет резервуара для накопления мочи, она выходит в пластиковые мочеприемники, прикрепленные к телу. Качество жизни этих людей оставляет желать лучшего: это постоянный запах мочи, затруднения в гигиенических процедурах, резко повышенный риск инфекции почек, часто — невозможность просто выйти на улицу. Между тем, существует несколько способов создания нового мочевого пузыря, так называемая неоцистопластика. Изолируется участок кишечника, туда пересаживаются мочеточники, создается анастомоз (соединение) с мочеиспускательным каналом. Это позволяет пациенту мочиться как обычно.

Важно знать и понимать, что в лечении рака мочевого пузыря важна не только операция. Комплексный подход, совместные усилия хирурга-онкоуролога, химиотерапевта, радиолога зачастую помогают не только спасти жизнь пациенту, но и сохранить качество его жизни. В Европейской онкологической клинике по поводу каждого пациента с раком мочевого пузыря обязательно проводится консилиум этих специалистов, что позволяет достигнуть хороших результатов. В сложных неоднозначных случаях мы стараемся получить «второе мнение» наших коллег из ведущих университетских клиник Австрии, Германии и Израиля.
Почему при обнаружении маленькой опухоли врач-онкоуролог рекомендует выполнение расширенного обследования костей, печени, легких?
В онкологии нет понятия «маленькая опухоль». Есть понятие «стадия». В довольно большом количестве случаев первичная опухоль не превышает полсантиметра, однако она уже успела «забросать метастазами» отдаленные органы. Если просто удалить опухоль, даже удалить радикально, вместе с мочевым пузырем, то человека убьет метастаз, который вовремя не был выявлен.
Иммунотерапия при раке мочевого пузыря
Иммунотерапия — современное, активно развивающееся направление в лечении онкологических заболеваний, на которое многие врачи и ученые возлагают большие надежды. Применяется она и при злокачественных опухолях мочевого пузыря.
Внутрипузырное введение вакцины БЦЖ практикуется уже более 30 лет. В мочевой пузырь, зачастую после трансуретральной резекции опухоли на ранней стадии, вводят ослабленные туберкулезные палочки. Они не могут вызвать туберкулез, но активируют клетки иммунной системы, которые начинают «замечать» и атаковать опухоль.
Более современное направление в иммунотерапии злокачественных опухолей мочевого пузыря — применение ингибиторов контрольных точек. Контрольные точки — это молекулы, которые использует иммунная система, чтобы не допустить атаки на здоровые ткани. Эти молекулы иногда используют опухолевые клетки, чтобы подавить иммунный ответ. Ингибиторы контрольных точек помогают снять этот блок:
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенсио), дурвалумаб (Имфинзи).
- Блокаторы PD-1: ниволумаб (Опдиво), пембролизумаб (Кейтруда).
Цены в Европейской онкологической клинике на лечение рака мочевого пузыря
- Консультация онколога — 5100 руб.
- Консультация химиотерапевта — 6900 руб.
- Проведение внутрибрюшной химиотерапии (инфузия, без стоимости лекарственных препаратов) — 19100 руб.
- Резекция мочевого пузыря — 61000 руб.
- Резекция мочевого пузыря с резекцией мочеточника — 93800 руб.
- Трансуретральная резекция (ТУР) мочевого пузыря — 120000 руб.
- Расширяющая кишечная пластика мочевого пузыря — 85300 руб.
- Проведение химиотерапии (инфузия, без стоимости лекарственных препаратов) — 15000 руб.
- Проведение иммунотерапии (без стоимости лекарственных препаратов) — 15000 руб.
- Анти PD-1 терапия — 334000 руб.
Источник
Рак предстательной железы
Это означает, что каждый год как минимум 1,5 тыс. петербуржцев получают неприятное известие, вносящее значительные коррективы в их жизнь. Не менее половины заболевших страдают запущенными формами рака простаты и практически не имеют шансов на полное излечение (только на продление жизни, и то — при условии непрерывной терапии).
В США рак предстательной железы выявляется значительно чаще: заболеваемость в среднем превышает 150 человек на 100 тыс. мужского населения (имеет выраженные расовые отличия: у афроамериканцев — более 200, у китайцев — менее 50). При этом местно-распространенные и метастатические формы рака простаты встречаются не более чем у 25% пациентов. Остальные же 75% могут быть избавлены от недуга после адекватного радикального лечения.
Причины рака предстательной железы
В чем причина столь очевидных и неутешительных отличий?
Дело в том, что в развитых странах практически все мужское население старше 45-50 лет ежегодно сдает анализ крови на ПСА (простат-специфический антиген) и проходит ПРИ (пальцевое ректальное исследование простаты). Эти нехитрые и недорогие меры позволяют спасать миллионы жизней и экономить миллиарды долларов (лечить больных с ранними формами рака простаты не только эффективнее, но и значительно дешевле).
В связи с вышесказанным, сразу хочется призвать читателя, если ему уже исполнилось 45-50 лет, пойти в сертифицированную лабораторию и сдать анализ крови на ПСА, после чего обратиться к грамотному урологу за консультацией.
Доказанным фактором риска возникновения рака предстательной железы является наследственность. Если у отца обнаружен рак простаты, то у сына вероятность заболевания повышается в несколько раз по сравнению с общей популяцией. Также факторами риска рака простаты считаются особенности питания (преобладание животных жиров в рационе) и хронический воспалительный процесс в предстательной железе (хронический простатит).
Диагностика рака предстательной железы
На ранних стадиях (которые можно вылечить радикально) рак простаты чаще всего клинически не проявляется — никаких жалоб нет! В дальнейшем больные могут жаловаться на нарушения мочеиспускания (вялая струя мочи, ночные мочеиспускания, учащенные мочеиспускания и др.), боли в промежности, надлобковой области, в костях, пояснице, появление крови в моче, в сперме, отеки конечностей, слабость, быструю утомляемость и др.
Основным методом ранней диагностики рака простаты является анализ крови на ПСА. Ранее «нормальным» считался уровень ПСА — 4 нг/мл. Сегодня «тревожная граница» ПСА находится в среднем на уровне 2,5 нг/мл. Важно отметить, что ПСА может повышаться также при аденоме простаты, простатите и после различных манипуляций с органом (катетеризация уретры, биопсия, массаж и др.), поэтому каждый случай повышения ПСА надо рассматривать индивидуально.
После анализа ПСА больному выполняется пальцевое ректальное исследование — простата ощупывается доктором через прямую кишку пациента. Это исследование несложное и недорогое, но весьма информативное — пренебрегать им ни в коем случае не следует!
Следующим в алгоритме диагностики рака простаты обычно следует УЗИ или ТРУЗИ (трансректальное УЗИ — с использованием специального датчика, устанавливаемого в прямую кишку). При этом исследовании можно установить объем и конфигурацию простаты, изучить эхоструктуру органа (выявить «подозрительные» участки), оценить состояние верхних и нижних мочевых путей.
Обязательным исследованием в алгоритме диагностики рака простаты является трансректальная мультифокальная биопсия простаты под ультразвуковым контролем. Эта манипуляция позволяет забрать из предстательной железы пациента тонкие столбики ткани для последующего гистологического исследования. Значение биопсии простаты трудно переоценить: от результатов данного исследования зависит вся дальнейшая тактика лечения пациента! В результате изучения биопсийного материала врач-патологоанатом устанавливает наличие/отсутствие злокачественных клеток в ткани простаты (подтверждение/опровержение диагноза), протяженность поражения органа, степень дифференцировки опухоли (насколько рак «злой») и многие другие параметры. В связи с этим к биопсии предъявляется ряд требований, вот основные из них:
- манипуляция должна выполняться с использованием специального оборудования (трансректальный биопсийный датчик и соответствующее программное обеспечение ультразвукового аппарата);
- забор тканей должен производиться современными атравматичными биопсийными иглами (с применением биопсийных пистолетов или одноразовых устройств) — это сделает манипуляцию минимально болезненной и максимально эффективной;
- количество биопсийных вколов должно быть не меньше 6 (оптимальное количество — не менее 10-14, но могут быть и исключения) — от этого зависит вероятность обнаружения рака;
- полученные столбики тканей должны быть отправлены на исследование к квалифицированному патологоанатому, выполняющему исследования биопсийного материала простаты регулярно и в соответствии с современными международными требованиями.
В зависимости от конкретной клинической ситуации дополнительно (по показаниям) могут быть использованы МРТ (в том числе с эндоректальной катушкой), КТ, ПЭТ, радиоизотопное исследование костей скелета и др.
Обращаем Ваше внимание на то, что интернет-сайт uroportal.ru несет исключительно информационный характер. В действительности заболевание может протекать по другому. Не пытайтесь заниматься самостоятельной диагностикой и лечением, при наличии симптомов заболевания настоятельно рекомендуем обратиться за консультацией к специалисту.
Запись на консультацию к урологу
Методы лечения рака предстательной железы
Рак предстательной железы можно разделить на три формы, принципиально отличающиеся по степени распространенности опухолевого процесса, методам лечения и прогнозу: локализованный, местно-распространенный и генерализованный (метастатический) рак простаты.
Локализованный рак простаты не выходит за границы капсулы органа и не имеет метастазов.
Международным «золотым стандартом» лечения этой формы рака предстательной железы, обеспечивающим самую высокую онкоспецифическую выживаемость (около 90%), является радикальная простатэктомия (РПЭ). При этой операции происходит удаление всей простаты с семенными пузырьками и регионарными лимфатическими узлами (по показаниям). Все принципиальные этапы РПЭ четко сформулированы и выверены десятилетиями. Еще 15 лет назад РПЭ выполнялась практически только через открытые доступы: позадилонный и промежностный. Сегодня удаление простаты осуществляется также с помощью лапароскопии и предбрюшинно (эндоскопически) — с использованием лапароскопического оборудования, а также с применением робототехники (например, DaVinci). Необходимо еще раз отметить, что никаких ПРИНЦИПИАЛЬНЫХ отличий в технике операций, выполняемых тем или иным доступом нет — преимущество современных методик (удаление простаты с помощью лапароскопии) заключается в основном в уменьшении послеоперационных болей и более ранней активизации больного. Существует мнение, что эндоскопические методики позволяют более точно (прецизионно) выполнять манипуляции, что обеспечивает профилактику многих осложнений. Это утверждение верно только при условии весьма высокого уровня навыков оперирующего хирурга.
Наиболее частые и весьма неприятные осложнения РПЭ: эректильная дисфункция (40-90%) и недержание мочи (1-20%).
Первое осложнение далеко не всегда «актуально» для пациентов старшей возрастной группы. Проблемы с эрекцией после РПЭ в части случаев поддаются терапии препаратами группы ингибиторов ФДЭ-5 (виагра, сиалис, левитра). При неэффективности лекарственного лечения отличные результаты, как правило, обеспечивает имплантация современных протезов полового члена.
Актуальность так называемого «постпростатэктомического недержания мочи» очевидна для пациентов любой возрастной группы. Ранее эффективное лечение этого досадного осложнения обеспечивала только имплантация искусственного сфинктера уретры (AMS-800). Недостатками такой тактики являются: немалая стоимость эндопротеза (более 5 тыс. долларов), высокая вероятность возникновения дисфункции имплантата и/или развития реакций его отторжения (инфекционные осложнения, индивидуальная непереносимость полимера) — от 15-20 до 50-60% (по данным разных авторов). Кроме того, искусственный сфинктер — это устройство, которым надо адекватно управлять (помпа расположена в мошонке), а это бывает по силам не всем пациентам. Трудности возникают и в случае попадания пациента с имплантированным AMS-800, например, в реанимацию, где ему «насильно» устанавливают катетер, не зная о функционирующей манжете сфинктера. Это приводит к крайне серьезным осложнениям — некрозу стенки уретры с последующим образованием стриктур (сужений просвета мочеиспускательного канала).
К счастью, в последние годы появились действительно безопасные и эффективные технологии лечения легких и средних форм недержания мочи у мужчин — операции по имплантации под уретру синтетических слингов (лент). Этот подход совсем не нов, однако только недавно, благодаря совместным усилиям фирм-производителей и клиницистов, он приобрел конкретные, стандартизованные очертания. Наиболее известные слинговые системы для мужчин: InVance, AdVance, Argus, Remeex, I-Stop T.O.M.S. Настоящим прорывом в хирургическом лечении недержания мочи у мужчин можно назвать появление на рынке эндопротеза УроСлинг мужской (UroSling male). Этот эндопротез имеет уникальную макропористую структуру, устойчивую к растяжению и атравматичную для окружающих тканей. Кроме того, имплантат без применения дополнительных устройств надежно и безопасно фиксируется к нижним ветвям лонных костей, что обеспечивает ему высокую и стабильную эффективность. Немаловажным преимуществом УроСлинга мужского, разработанного российскими учеными и выпускающегося предприятием Линтекс (г. Санкт-Петербург), является доступная цена — не более 20 тыс. рублей. В то время как импортные аналоги, зачастую проигрывающие в качестве, стоят не менее 100 тыс. рублей.
Для минимизации вероятности возникновения недержания мочи и сохранения потенции в определенных клинических ситуациях возможно выполнение особой модификации РПЭ — так называемой «нервосберегающей» операции. Это подход статистически достоверно обеспечивает намного лучшие функциональные результаты, чем традиционный.
Кроме проблем с эрекцией и недержания мочи после РПЭ могут развиваться (со значительно меньшей частотой) стриктуры анастомоза (соединения) мочевого пузыря и мочеиспускательного канала, сердечно-сосудистые осложнения, массивное лимфоцеле (скопление лимфы в забрюшинном пространстве) и др.
Альтернативные (дополнительные) методы лечения локализованного рака предстательной железы:
- лучевая терапия,
- терапия высокоинтенсивным фокусированным ультразвуком,
- гормональная терапия.
Лучевая терапия принципиально подразделяется на дистанционную и внутритканевую.
Дистанционная терапия осуществляется из источников радиации, располагающихся вне тела пациента. Она может быть выполнена в стандартном варианте (конвенциальная) и 3D-конформном (позволяет более точно концентрировать пучки радиации на простате с минимальным воздействием на окружающие структуры). Лучевая терапия может быть использована как самостоятельный и дополнительный метод лечения. При использовании лучевой терапии как самостоятельного метода возможно полное излечение локализованного рака простаты без операции (результаты экспертных центров лишь незначительно уступают таковым при радикальной простатэктомии), при меньшей частоте развития недержания мочи и сопоставимой частоте эректильной дисфункции. Но, к сожалению, имеется немало «подводных» камней, ограничивающих широкое применение данной методики, среди них:
- длительность курса терапии (до 2 месяцев);
- невозможность точного стадирования опухолевого процесса и определения радикальности лечения (отсутствует удаленный препарат простаты и лимфатических узлов);
- трудно поддающиеся лечению специфические осложнения, связанные с воздействием радиации на мочевой пузырь и прямую кишку (лучевой цистит, лучевой проктит) и др.
Внутритканевая лучевая терапия (брахитерапия) заключается во введении в ткань предстательной железы радиоактивных зерен. Благодаря этому удается создать высокую очаговую дозу ионизирующего излучения на ткань простаты. В экспертных центрах метод позволяет достичь результатов, практических сопоставимых с радикальной простатэктомией. При этом, в отличие от дистанционной лучевой терапии, требуется лишь однократная процедура имплантации радиоактивных зерен через промежность специальной тонкой иглой под ультразвуковым наведением. Брахитерапия позволяет у большинства пациентов сохранить потенцию и обеспечивает достаточно низкий риск недержания мочи. Но, опять же, есть ряд нюансов, не позволяющих сделать брахитерапию «золотым стандартом», вот некоторые из них:
- невозможность точного стадирования опухолевого процесса и определения радикальности лечения (отсутствует удаленный препарат простаты и лимфатических узлов);
- метод подходит только для пациентов с минимальной распространенностью опухолевого процесса (далеко не все случаи даже локализованного рака простаты);
- ограничения по объему предстательной железы — <50 мл;
- процедура не подходит для пациентов, имеющих выраженные расстройства мочеиспускания (затрудненное мочеиспускание, вялая струя мочи, частые мочеиспускания, выраженные позывы, многократные ночные походы в туалет, недержание мочи и т.д.);
- послеоперационный период нередко осложняется такими проблемами, как острая задержка мочеиспускания, что требует дополнительных лечебных мероприятий.
HIFU (High Intensity Focused Ultrasound) — высокоинтенсивный фокусированный ультразвук — одна из относительно новых методик лечения локализованного рака простаты. Суть метода заключается в том, что через датчик, распложенный в прямой кишке пациента, под ультразвуковым контролем на ткань простаты осуществляется прицельное термическое воздействие, что приводит к гибели опухолевых клеток. Несмотря на свою «молодость», данный подход получил достаточно широкое распространение в мире. Причина тому — самая минимальная инвазивность (травматичность) из всех методов лечения рака предстательной железы при достаточно высокой эффективности (в опытных руках). Необходимо отметить, что HIFU — процедура достаточно «капризная» и требует очень тщательного отбора «подходящих» для нее пациентов. От этого выбора во многом зависит, будет ли процедура эффективна (подходят только пациенты с очень ранними формами рака простаты), и насколько высока будет вероятность осложнений, которых, к сожалению, не так уж мало (острая задержка мочи, стриктуры простатического отдела уретры, недержание мочи и др.). В любом случае — методика многообещающая, но однозначно говорить о ее месте в лечении рака простаты пока преждевременно.
Рак предстательной железы — заболевание, развитие которого зависит от уровня мужских половых гормонов (андрогенов) в крови. Чем их уровень ниже — тем медленнее развивается опухоль. Поэтому еще одним методом лечения рака предстательной железы является гормональная терапия, которая сводится к максимальной андрогенной «блокаде». Этот подход при локализованном раке применяется только как дополнение к основному лечению рака простаты. Самый простой, дешевый и относительно безопасный метод снижения уровня половых гормонов — двустороннее удаление ткани яичек (хирургическая кастрация). На сегодняшний день — это «золотой стандарт» антиандрогенной терапии. Понятно, что данный подход весьма неприятен для многих пациентов, так как, по их мнению, они «лишаются мужского достоинства». Есть и другой способ лечения — медикаментозная «кастрация», когда назначаются препараты, блокрующие выработку андрогенов. Современные препараты этой группы по эффективности и уровню безопасности приближаются к удалению ткани яичек.
Местно-распространенный рак простаты выходит за пределы органа, но не поражает прилежащие структуры и не имеет метастазов. Лечение этой формы рака простаты — проблема достаточно сложная и дискутабельная. Решение о методе лечения должно приниматься строго индивидуально и на основании всестороннего обследования. В любом случае, лечение пациентов с местно-распространенным раком простаты должно быть комплексным. Для потенциально «операбельных» пациентов это может быть комбинация радикальной простатэктомии с последующей (адъювантной) лучевой терапией и/или гормональной терапией. Либо самостоятельное применение лучевой терапии с последующей гормональной и т.д. Использование современных методов лечения данной категории пациентов позволяет обеспечить 5-ти летнюю выживаемость на уровне 70-80%.
Метастатический (генерализованный) рак предстательной железы, несмотря на 21 век, наступивший в нашей стране уже достаточно давно, к сожалению, не является редкостью. Очень часто запущенная злокачественная опухоль простаты — следствие несовершенства системы здравоохранения, безграмотности конкретного доктора и беспечности пациента. От многих больных приходится слышать, что они обратились к врачу с симптомами «простатита» или «аденомы» еще «лет 5 назад» и с тех пор упорно (и не очень) лечились. А когда задаешь такому пациенту вопрос: «Вы сдавали кровь на ПСА?». Получаешь традиционный ответ: «А что это такое?». Пока данная ситуация не изменится в корне, онкоурологам только и остается, что выставлять диагнозы-приговоры каждому четвертому пациенту.
Основная особенность генерализованного рака предстательной железы — наличие метастазов в лимфоузлах, костях, легких, печени и других органах. При этой форме заболевания удаление простаты или воздействие на ее радиацией — дело бесполезное. Грамотный доктор может сделать только две вещи (не считая моральной поддержки):
- Замедлить развитие опухолевого процесса и тем самым продлить жизнь пациента (гормональная, а при ее неэффективности — цитотоксическая терапия);
- Улучшить качество жизни пациента и/или бороться с угрожающими жизни осложнениями РПЖ (налаживание оттока мочи, остановка кровотечений, обезболивание, предотвращение переломов костей из-за метастазов и др.).
Обобщая вышесказанное, можно с уверенностью утверждать, что лечение локализованного и метастатического рака простаты, это «две большие разницы». Если Вы фаталист — ежегодная сдача ПСА после 45-50 лет — конечно, не для Вас. Во всех остальных случаях — на сегодня это единственный способ выявить рак предстательной железы на ранней, потенциально излечимой, стадии.
Будьте здоровы!
Источник