Метастатический рак мочевого пузыря лечение
Содержание статьи
Лечение метастатического рака мочевого пузыря
Приблизительно у 30% больных переходно-клеточным раком определяется инвазия опухоли в мышечный слой; у половины разовьется рецидив после выполнения радикальной цистэктомии, что определяется морфологической стадией первичной опухоли и состоянием регионарных лимфатических узлов.
Местные рецидивы составляют 30% всех рецидивов, тогда как большинство представлено отдаленными метастазами.
Около 10-15% пациентов на момент постановки диагноза уже имеют отдаленные метастазы.
До разработки эффективных схем химиотерапии медиана выживаемости больных с отдаленными метастазами переходно-клеточного рака составляла 3-6 мес. Рак мочевого пузыря (РМП) относится к химиочувствительным опухолям. Уровень объективных ответов различается в зависимости от прогностических факторов и распространения болезни до начала терапии. Выявлены прогностические факторы, влияющие на объективный ответ и выживаемость.
При многофакторном анализе в качестве независимых факторов, негативно влияющих на общую выживаемость после лечения по схеме MVAC, выделены: статус по шкале Карновского 80% и менее и наличие висцеральных метастазов. Эти так называемые Bajorin-факторы прогноза также работают при современной химиотерапии и являются ключевыми для оценки результатов исследований II фазы и факторами стратификации для исследований III фазы.
В дальнейшем было выявлено прогностическое влияние уровня щелочной фосфатазы и числа зон, пораженных метастазами (3), При ретроспективном анализе в качестве независимых факторов, предсказывающих низкую выживаемость, выделены: статус ECOG (Eastern Cooperative Oncology Group) 2-3 и уровень гемоглобина менее 100 г/мл.
Возраст сам по себе не оказывал влияния ни на объективный ответ, ни на переносимость химиотерапии. Кроме этих прогностических факторов, на выбор терапии влияет функциональное состояние почек: является ли оно адекватным для назначения цисилатинсодержащих режимов (клиренс креатинина >60 мл/мин, общее состояние, сопутствующая патология).
Монохимиотерапия
Представлены различия в объективном ответе на химиотерапию I линии одним препаратом: 12% при терапии цисплатином (сопоставимо с MVAC), 12% — для карбоплатина, 42% — для паклитаксела, 31% — для доцетаксела, 29% — для метотрексата, 19% — для адриамицина, 15% — для эпирубицина, 13% — для митомицина С, 35% — для 5-фторурацила, 14% — для винбластина, 29% — для ифосфамида, 8% — для циклофосфамида. В крупных исследованиях II фазы назначение гемцитабина как на I, так и на II линии показывает наиболее устойчивые результаты — уровень объективного ответа 25%.
Ответ на химиотерапию одним препаратом, как правило, недолговечный, а полные эффекты редки. Отметим, что не сообщается о длительных периодах времени без прогрессирования при химиотерапии одним препаратом. Медиана общей выживаемости у таких больных составляет 6-9 мес.
Больные с общим состоянием по шкале ВОЗ 3-4 без дополнительных негативных прогностических факторов не испытывают улучшения от назначения комбинированной химиотерапии. Наиболее адекватным подходом для этой группы больных является наилучшее поддерживающее лечение (симптоматическая терапия) или самое большое — химиотерапия одним препаратом.
Стандартная химиотерапия первой линии
Цисплатинсодержащие комбинации химиопрепаратов являются стандартом лечения начиная с конца 80-х годов прошлого столетия. Режим MVAC оказался эффективнее монотерапии цисплатином, режима CISCA (цисплатин, циклофосфамид и адриамицин) и. как было недавно показано, режима цисплатин/доцетаксел.
Схемы MVAC и гемцитабин/цисплатин увеличивают медиану общей выживаемости до 14,8 и 13,8 мес соответственно. Ни одна из этих двух комбинаций не показала превосходства над другой, но их равнозначность тоже не тестировалась, при этом уровень объективных ответов составил 46 и 49% для MVAC и GC соответственно.
Результаты длительной выживаемости подтверждают возможную равнозначность обоих режимов. Основное различие между описанными схемами лежит в переносимости режимов: GC менее токсичен, MVAC лучше переносится при использовании гранулоцитарного колониестимулирующего фактора (ГКСФ).
Бысокодозный и интенсивный вариант режима MVAC с поддержкой GCSF менее токсичен и более эффективен, чем стандартная схема MVAC, в переводе на интенсивность доз препаратов, в отношении объективных эффектов и уровня 2-летней общей выживаемости. Тем не менее не получено статистически значимых различий медиан общей выживаемости между двумя вариантами режима.
Еще продолжает изучаться дальнейшая интенсификация режимов путем использования новых триплетов, доз препаратов и режима их введения и добавление таргетных препаратов. Эти подходы следует пока оставить в рамках клинических исследований, а не использовать в рутинной практике.
Химиотерапия первой линии с включением карбоплатина
Не доказана эквивалентность схем с включением карбоплатина в цисплатинсодержащие комбинации. Однако, вероятно, она ниже, и поэтому эти режимы не должны рассматриваться как равноценные или не должны считаться стандартом терапии.
Единственное рандомизированное исследование III фазы, сравнивающее схемы паклитаксел/карбоплатин и MVAC, было досрочно прекращено, так как проведение карбоплатинсодержащего режима ассоциировалось с разочаровывающе низким уровнем ответа — только 28,2%. Поэтому нет доказательств того, что этот дуплет может обладать адекватной эффективностью на I линии химиотерапии.
В различных исследованиях II фазы по сравнению комбинаций с карбоплатином или цисплатином отмечены более низкий уровень ответа и более короткая общая выживаемость в группах карбоплатина.
Неплатиновые комбинации химиотерапии
Комбинация гемцитабина и паклитаксела в различных режимах изучалась как на I, так и на II линии терапии. Не считая серьезной легочной токсичности при еженедельном назначении обоих препаратов, эта комбинация показала хорошую переносимость и обеспечила объективный ответ на уровне между 38 и 60% на обеих линиях химиотерапии.
По причине отсутствия рандомизированного сравнения стандартной цисплатинсодержащей химиотерапии с неплатиновой комбинацией последняя не рекомендуется к применению на I линии у больных, «подходящих» для проведения химиотерапии.
Химиотерапия соматически отягощенных пациентов
До 50% больных не подходят для проведения химиотерапии с включением цисплатина либо по причине тяжелого общего состояния и/или недостаточной функции почек, либо из-за сопутствующей патологии, что не позволяет проводить пациенту гидратацию большим объемом.
Назначение неплатиновых комбинаций на I линии у больных с двумя неблагоприятными прогностическими факторами (GFR 2) следует ограничить исследовательскими протоколами, так как они не изучены у таких больных и. возможно, будут более токсичными. Очень мало исследований с ясно определенными «подходящими» больными или пациентами со множественными неблагоприятными факторами прогноза.
Тем не менее в настоящее время EORTC уже проводит первое рандомизированное исследование фазы II/III по данной тематике. Оно сравнивает карбоплатин/винбластин/метотрексат и карбоплатин/гемцитабин у больных, «не подходящих» к назначению цисплатина.
Химиотерапия второй линии
Данные по II линии химиотерапии очень разнятся, а прогностические факторы в этой области неясны. К предполагаемым прогностическим факторам относятся: характер I линии химиотерапии (адъювантная/неоадъювантная). предшествующая чувствительность к химиопрепаратам, общее состояние и Bajorin-факторы прогноза. Пока не существует достаточно данных по определению стандартной химиотерапии в данных условиях. Повторное назначение предшествующей химиотерапии через 1-2 мес и более после достижения эффекта является оправданной тактикой.
По данным небольших исследований II фазы, объективный ответ на паклитаксел (еженедельно), доцетаксел, оксалиплатин, топотекан, лапатиниб, гефетиниб и бортезомиб находится в пределах 0-13%. Использование гемцитабина на II линии химиотерапии показало прекрасный результат. Однако большинство больных уже получали этот препарат в схемах I линии терапии. Винфлунин, новый препарат III поколения группы винкалкалоидов, показал объективный ответ на уровне 18% и контроль болезни на уровне 67%.
Ожидается выход в печать результатов рандомизированного исследования III фазы, сравнивающего назначение винфлунина с поддерживающей терапией. Применение пеметрекседа 500 мг/м2 каждые 3 нед в исследовании II фазы показало обнадеживающие результаты: объективный ответ у 25% больных и легкоуправляемая токсичность при дополнительном назначении витамина B12, фолиевой кислоты и профилактическом назначении дексаметазона. Прекрасные показатели объективного ответа не могут быть подтверждены вторым небольшим исследованием; этот результат может быть связан с отбором пациентов в исследование.
Объективный ответ на ифосфамид составил 20%, но отмечена тенденция к выраженной токсичности. Объективный ответ при назначении паклитаксела/гемцитабина отмечен у 38-60% больных, что зависело от эффекта предшествующей терапии и показаний к химиотерапии I линии. К сожалению, не проводится ни одного рандомизированного исследования по оценке полученных результатов при данной комбинации И линии.
Заболевание с небольшим распространением и оперативное лечение после химиотерапии
При назначении цисплатинсодержащей химиотерапии больным с метастазами только в регионарных лимфатических узлах в удовлетворительном общем состоянии и при адекватной функции почек можно достичь прекрасного уровня ответа, включая высокую частоту полных эффектов, а у 20% пациентов наблюдается длительная выживаемость без прогрессирования. Миграция стадии может играть роль в получении этих положительных результатов.
Ретроспективное исследование по удалению резидуальной опухоли после достижения частичного или полного эффекта показало, что данные операции могут приводить к увеличению выживаемости, свободной от болезни, у отобранных больных. Нет достаточно доказательств о преимуществе рутинного применения адъювантной химиотерапии.
К настоящему времени опубликовано всего пять рандомизированных исследований по адъювантной химиотерапии и один метаанализ с обновленными данными по конкретным больным из шести исследований, а для анализа выживаемости использованы данные по 491 больному.
В.И. Чиссов, Б.Я. Алексеев, И.Г. Русаков
Опубликовал Константин Моканов
Источник
Лечение рака мочевого пузыря
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последнего поколения с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название — переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа — уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1–2% случаев (по данным Американского онкологического сообщества — American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев — аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев — мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы — злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N — наличие очагов поражения в регионарных лимфоузлах, M — наличие отдаленных метастазов в других органах.

В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 — неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии — это инвазивный рак.
- Стадия I — опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II — опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III — злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1—3), отдаленных метастазов нет (M0).
- Стадия IV — злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
Важно внимательно относиться к своему здоровью, обращать внимание на любые симптомы, которые сохраняются в течение длительного времени, и при их возникновении сразу обращаться к врачу.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
- Цитологическое исследование мочи — её изучение под микроскопом на предмет наличия опухолевых клеток. Этот анализ иногда помогает диагностировать рак на ранних стадиях, но он не идеален.
- Исследование мочи на онкомаркеры — вещества, повышение уровней которых может свидетельствовать о злокачественной опухоли. Это также не совсем надежный тест.
- Цистоскопия — эндоскопическое исследование мочевого пузыря, когда в орган вводят специальный инструмент — цистоскоп — с видеокамерой. Наиболее информативна так называемая цистоскопия с синим светом. В мочевой пузырь вводят специальный препарат, который накапливается в опухолевых клетках и заставляет их флуоресцировать («светиться») в лучах синего света.
- Биопсия — исследование, во время которого получают фрагмент патологически измененной ткани и изучают в лаборатории под микроскопом. Это самый надежный способ разобраться, присутствуют ли в патологическом образовании раковые клетки, и является ли оно злокачественным. Материал для биопсии можно получить во время цистоскопии.
- Внутривенная пиелография. Пациенту внутривенно вводят раствор рентгеноконтрастного препарата, который затем начинает выводиться почками и «прокрашивает» мочевыводящие пути на рентгеновских снимках. Это помогает обнаружить опухоли.
- Ретроградная пиелография — исследование, во время которого рентгеноконтрастный раствор вводят через катетер, установленный в мочевом пузыре или мочеточнике.
- Ультразвуковое исследование помогает оценить размеры опухоли, выяснить, не распространилась ли она за пределы мочевого пузыря, проверить состояние почек. Под контролем УЗИ в обнаруженную опухоль можно ввести иглу и провести биопсию.
- Компьютерная томография и МРТ помогают оценить размеры, расположение, количество опухолевых очагов, обнаружить распространение рака на соседние органы, в лимфатические узлы, выявить метастазы. Под контролем КТ также можно провести биопсию с помощью иглы.
- Рентгенографию применяют для поиска метастазов в легких, костях.
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Как выбирают лечение при раке мочевого пузыря?
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
Хирургическое лечение
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент — резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
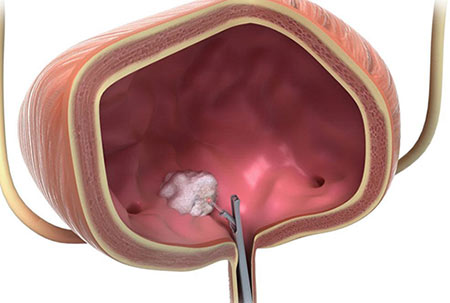
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию — удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.
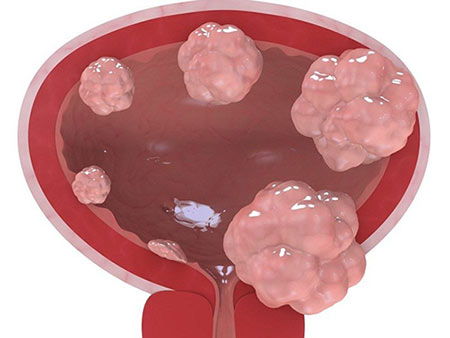
Большинству больных приходится выполнять цистэктомию — полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин — семенные пузырьки и простату, у женщин — матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения — когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция — когда хирург подсоединяет к одному концу кишки мочеточники, а к другому — мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиотерапия
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
- Неоадъювантную химиотерапию проводят до хирургического вмешательства. Благодаря препаратам опухоль уменьшается, и ее становится проще удалить.
- Адъювантная химиотерапия применяется после операции. Если в организме пациента остались раковые клетки, химиопрепараты их уничтожают, за счет этого снижается риск рецидива.
- Химиолучевая терапия — когда химиопрепараты назначают «в помощь» лучевой терапии. За счет этого повышается эффективность лечения рака.
- Паллиативная химиотерапия — один из основных методов лечения на поздних стадиях, когда опухоль неоперабельна, имеются отдаленные метастазы. Химиопрепараты помогают продлить жизнь пациента и избавить от некоторых симптомов.
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.
Лучевая терапия
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Иммунотерапия рака мочевого пузыря
Иммунитет человека умеет уничтожать не только болезнетворные микроорганизмы, проникшие извне, но и собственные клетки, в генах которых возникли «ошибки». Именно из-за таких «ошибок» нормальная клетка превращается в раковую. Однако, опухолевые клетки умеют «обманывать» иммунитет, и используют для этого сложные молекулярные механизмы.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2–3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10–15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса — для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухоли, состояния здоровья пациента, наличия и отсутствия у него противопоказаний.
Оптимальные методы лечения злокачественных опухолей мочевого пузыря прописаны в специальных документах — протоколах. Они составлены на основе результатов многочисленных клинических исследований с участием тысяч пациентов по всему миру и регулярно пересматриваются, обновляются.
Врачи в Европейской клинике руководствуются последними версиями американских, европейских, израильских протоколов лечения.
Насколько эффективны современные методы лечения, каков прогноз?
В среднем в течение 5 лет остаются в живых 77% пациентов, в течение 10 лет — 70%, в течение 15 лет — 65%. Пятилетняя выживаемость при злокачественных опухолях мочевого пузыря зависит от стадии:
- Стадия 0–98%.
- Стадия I—88%.
- Стадия II—63%.
- Стадия III—46%.
- Стадия IV—15%.
В настоящее время проводятся клинические исследования, врачи ищут более эффективные способы борьбы с заболеванием, а значит, есть надежда, что в ближайшем будущем эти показатели улучшатся.
Источник