М рецепторы мочевого пузыря
Содержание статьи
изиология мочевого пузыря. Иннервация мочевого пузыря
Физиология мочевого пузыря. Иннервация мочевого пузыряМочеиспускание — процесс, в результате которого опорожняется наполненный мочевой пузырь. Процесс состоит из двух этапов. Первый этап — постепенное наполнение мочевого пузыря до тех пор, пока напряжение его стенок не достигнет предельного уровня, что приводит ко второму этапу, на котором благодаря рефлексу мочеиспускания происходит опорожнение мочевого пузыря или возникает осознанный позыв к мочеиспусканию. Несмотря на то, что рефлекс мочеиспускания регулируется автономной нервной системой с центрами в спинном мозге, он может быть заторможен или активирован под влиянием корковых или стволовых структур.
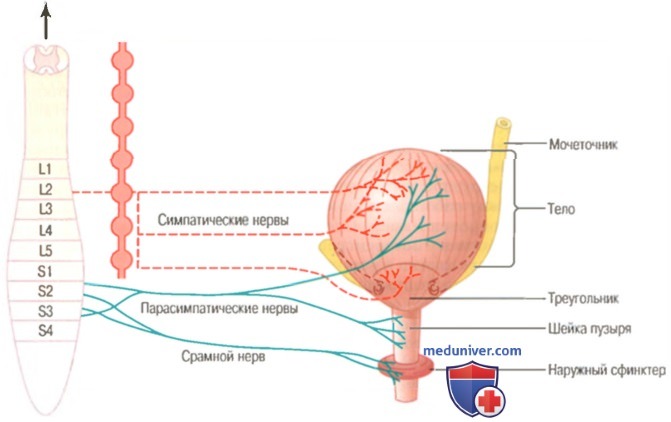
а) Физиологическая анатомия и нервные связи мочевого пузыря. Мочевой пузырь, изображенный на рисунке выше, представляет собой камеру из гладких мышц и состоит из двух основных частей: (1) тела, в котором собирается моча; (2) шейки — воронкообразного продолжения тела, идущего вниз и кпереди в область урогенитального треугольника, соединяясь с уретрой. Нижнюю часть шейки пузыря из-за связи с уретрой также называют задней уретрой. Гладкую мышцу пузыря называют детрузором. Его мышечные волокна распространяются во всех направлениях, при сокращении мышцы давление в пузыре возрастает от 40 до 60 мм рт. ст. Следовательно, сокращения детрузора является главным моментом опорожнения пузыря. Гладкие мышцы детрузора, соединяясь в единое целое, создают между собой электрические контакты с низким сопротивлением. Следовательно, потенциал действия способен распространяться по детрузору от клетки к клетке, вызывая затем одновременное сокращение всего органа целиком. На задней стенке пузыря, сразу выше шейки, находится небольшая треугольная область, называемая мочевым треугольником. Самый нижний угол треугольника обращен к задней уретре. Два мочеточника впадают в мочевой пузырь в области верхних углов треугольника. Опознать область треугольника можно по следующему признаку: слизистая оболочка, выстилающая пузырь изнутри, в области треугольника является гладкой в отличие от других частей, где она образует складки. Каждый мочеточник перед впадением в мочевой пузырь направляется к нему под косым углом, проходя в толще детрузора под слизистой на протяжении 1-2 см. Длина шейки пузыря (задней уретры) составляет 2-3 см, ее стенка состоит из мышечных волокон детрузора, переплетенных с большим количеством эластических волокон. Мышечную ткань данной области называют внутренним сфинктером. Его тонические сокращения в норме не позволяют моче находиться в шейке и задней уретре, предотвращая таким образом опорожнение мочевого пузыря до тех пор, пока давление в нем не достигнет критической величины. Задняя уретра, продолжаясь, прободает урогенитальную диафрагму, содержащую мышечный слой, называемый наружным сфинктером мочевого пузыря. Эта мышца — поперечнополосатая, ее сокращения — произвольные в отличие от других отделов мочевого пузыря, стенка которого содержит гладкие мышцы. Мускулатура наружного сфинктера находится под контролем нервной системы, подчиняясь сознанию. Такой осознанный контроль способен подавить непроизвольную попытку опорожнить мочевой пузырь. б) Иннервация мочевого пузыря. Основная иннервация мочевого пузыря осуществляется тазовыми нервами, являющимися частью крестцового сплетения спинного мозга, в основном на уровне S2 и S3. В состав тазовых нервов входят как чувствительные, так и двигательные волокна. Информация о степени растяжения стенки мочевого пузыря распространяется по чувствительным волокнам. Сигналы о растяжении задней уретры особенно интенсивны, именно они в основном ответственны за активацию рефлексов, направленных на опорожнение мочевого пузыря. Двигательные волокна тазовых нервов являются парасимпатическими, они заканчиваются в ганглиях стенки пузыря, откуда берут начало короткие постганглионарные волокна, иннервирующие детрузор. Помимо парасимпатической иннервации с помощью тазовых нервов в нервной регуляции мочевого пузыря участвуют еще два вида волокон. Наиболее важными являются соматические двигательные волокна, иннервирующие с помощью срамного нерва произвольную скелетную мускулатуру наружного сфинктера пузыря. Мочевой пузырь также получает симпатическую иннервацию от подчревного нерва, содержащего волокна в основном от сегмента L2 спинного мозга. Эти симпатические волокна иннервируют преимущественно сосуды и мало влияют на сокращения стенки. В составе симпатических нервов содержатся также чувствительные волокна, способные играть важную роль в формировании ощущений переполнения пузыря и в некоторых случаях — боли. — Также рекомендуем «Движение мочи из почки. Наполнение мочевого пузыря и его тонус» Оглавление темы «Физиология почек и их функция»: |
Источник
Современные подходы к фармакотерапии гиперактивного мочевого пузыря
Комментарии
Опубликовано в журнале:
Эффективная фармакотерапия в урологии, №2 апрель 2010 Е.Н. Голубцова, Е.И.Велиев
РМАПО, Москва
Гиперактивный мочевой пузырь (ГАМП) является широко распространенным заболеванием, одинаково поражающим мужчин и женщин, частота которого увеличивается с возрастом. Распространенность данной нозологии в США и Европе составляет в среднем от 12 до 17%. В возрасте 40-44 лет мужчины и женщины заболевают с частотой З и 9% соответственно. В популяции 75 лет и старше — 42 и 31% пациентов мужского и женского пола страдают симптомами ГАМП. По данным National Overactive Bladder Evaluation (NOBLE), ГАМП страдают около 33 млн человек в США старше 18 лет, что значительно ухудшает качество их жизни, снижает работоспособность и социальную активность (1,2,3).
ГАМП — это синдром, включающий, по определению International Conitnence Society, наличие ургентных позывов к мочеиспусканию в сочетании с недержанием мочи или без него, обычно сопровождающийся увеличением количества дневных мочеиспусканий и ноктурией (4).
Этиология и патогенез ГАМП окончательно не изучены, однако ведущей причиной учащенного и ургентного мочеиспускания (основных составляющих симптомокомплекса ГАМП) у большинства больных является гиперактивность детрузора. Последнее проявляется в повышении числа его спонтанных сокращений, увеличении детрузорного давления в фазу накопления и, следовательно, уменьшении эффективной емкости мочевого пузыря.
Сокращения детрузора (как в норме, так и спонтанные) обусловлены воздействием ацетилхолина на мышечные волокна посредством постганглионарных М-холинорецепторов. Существует 5 основных типов М-холинорецепторов, расположенных в ЦНС, периферических ганглиях, секреторных железах, гладкой мускулатуре, легких. В детрузоре локализованы преимущественноМ2-иМЗ-холинорецепторы. Несмотря на преобладание М2-холинорецепторов (около 80%), за сокращения волокон детрузора ответственны главным образом МЗ-холинорецепторы (около20%). Роль М2-холинорецепторов остается до конца не изученной, однако в функциональном отношении они противостоят бета-адренорецепторам, посредством которых осуществляется расслабление детрузора (5).
Несмотря на высокую распространенность ГАМП и доступность терапевтических методик, проблема диагностики и лечения остается нерешенной. Многие пациенты воспринимают симптомы расстройства мочеиспускания как естественные возрастные изменения или полагают, что хирургическое вмешательство — единственно возможный метод лечения. Другие пытаются самостоятельно справиться с заболеванием, используя различные приспособления, чтобы скрыть подтекание мочи и другие симптомы ГАМП. Кроме того, многие врачи недостаточно осведомлены о последних достижениях в области фармакотерапии гиперактивности или считают, что доступные медикаменты неэффективны или сопряжены с тяжело переносимыми побочными эффектами (б).
Лечение пациентов с ГАМП является комплексным, ступенчатым и включает поведенческую терапию, фармакотерапию, инъекции нейротоксина ботулина типа А в детрузор, нейромодуляцию. Несколько рандомизированных контролируемых клинических исследований показали эффективность упражнений для тренировки мышц тазового дна в уменьшении симптомов ургентного и смешанного недержания мочи в группе пациенток до 75 лет (7). Низкочастотная электростимуляция мочевого пузыря посредством ректальных или вагинальных зондов оказывает ингибирующее влияние на сокращения детрузора, что в сочетании с поведенческой терапией также способствует улучшению клинической картины (8). Доказана эффективность интрадетрузорных инъекций нейротоксина ботулина типа А в уменьшении симптомов ГАМП и улучшении уродинамических показателей (9). В случае тяжелой нейрогенной гиперактивности детрузора у ограниченной группы пациентов возможно применение сакральной нейромодуляции (10). При неэффективности консервативного лечения показано применение хирургических методов, включая нейролизис и аугментационную цистопластику (11,12).
Исходя из патогенеза ГАМП, к терапии первой линии относится назначение антихолинергических препаратов. Крупномасштабные, мультицентровые, рандомизированные, плацебо-контролируемые исследования показали, что пациенты, получающие М-холиноблокаторы, отмечают значительное уменьшение числа мочеиспусканий, эпизодов ургентности и недержания (13,14).
Chappie С. и соавт. провели мета-анализ используемых в настоящее время М-холинолитиков и оценили эффективность, безопасность и переносимость отдельных препаратов, включая пероральные и трансдермальные формы. Значительное снижение ургентных позывов в течение суток отмечено у пациентов, получавших толтеродин 4 мг/ день, в сравнении с группой получавших плацебо. В отношении снижения числа эпизодов недержания мочи доказана клиническая значимость оксибутинина пероральной и трансдермальной форм, солифенацина 5 и 10 мг/день, толтеродина быстрого и медленного высвобождения. Уменьшение частоты мочеиспусканий и увеличение объема выделенной мочи происходило при назначении толтеродина быстрой и медленной форм высвобождения, солифенацина 5 и 10 мг/ день, трансдермальной формы оксибутинина (14).
При назначении антихолинергических препаратов следует учитывать, в какие сроки от начала лечения происходит улучшение клинической симптоматики. Многочисленные исследования показывают, что регулярный прием М-холиноблокаторов приводит к уменьшению симптомов гиперактивности в течение 1-2 недель лечения, а максимальный эффект достигается к 6-9 неделям. По данным Sussman D. и соавт., более половины пациентов отметили снижение частоты мочеиспусканий, эпизодов ургентности и недержания на 50% и более уже после 5 дней применения толтеродина (15). У пациентов, получавших дарифенацин, улучшение клинической картины наблюдалось через 2 недели приема препарата (16). Следует отметить, что для достижения и поддержания максимального терапевтического эффекта терапия М-холинолитиками должна быть длительной, так как после отмены антихолинергических препаратов нередко развивается рецидив симптомов ГАМП.
Структура и химический состав лекарственного средства существенно влияют на его фармакокинетику, обусловливая таким образом различные клинические эффекты. Третичные амины подвергаются метаболизму с участием цитохрома Р450 и, обладая большей липофильностью, легче абсорбируются из желудочно-кишечного тракта и проникают через гематоэнцефалический барьер, что может вызывать побочные эффекты, связанные с нарушениями в когнитивной сфере. Троспиум, являясь четвертичным гидрофильным амином, метаболизируется практически без участия цитохрома Р450. Около 80% этого препарата выводится в неизмененном виде с мочой, что объясняет его непосредственный эффект на уротелий мочевого пузыря (17). Период полувыведения (Т1/2) М-холиноблокаторов колеблется от 2 часов у оксибутинина и толтеродина быстрой формы высвобождения (18) до 45-68 часов у солифенацина (19). При этом фармакологически активный 5-гидроксиметильный метаболит толтеродина обладает Т1/2 продолжительностью 3-4 часа (20).
Большинство антимускариновых препаратов, оцененных в мета-анализе Chappie С. и соавт. (дарифенацин, пропиверин быстрого и медленного высвобождения, солифенацин, толтеродин быстрого и медленного высвобождения, троспиум), были хорошо переносимы пациентами. Наибольший риск прекращения лечения в связи с неудовлетворительной переносимостью имел оксибутинин быстрой формы высвобождения. Пациенты, получавшие данный препарат в дозе 8,8-15 мг в день, имели на 40% выше частоту отказа от лечения в сравнении с группой принимавших плацебо. При анализе профиля толерантности доказаны преимущества толтеродина обеих форм, оксибутинина медленного высвобождения. Остальные препараты, кроме оксибутинина быстрой формы высвобождения, имели приблизительно одинаковую переносимость (14).
Важным показателем антихолинергических препаратов является их селективность в отношении МЗ-холинорецепторов детрузора мочевого пузыря. Таким образом, М-холиноблокаторы можно разделить по сродству к МЗ-холинорецепторам на неселективные и МЗ-селективные. Характерной чертой неселективных препаратов является отсутствие специфичности в отношении мускариновых рецепторов третьего типа детрузора мочевого пузыря и, следовательно, воздействие на М-холинорецепторы других органов, что способствует развитию побочных эффектов. Главное отличие селективных препаратов заключается в их преимущественном взаимодействии с МЗ-холинорецепторами волокон детрузора, что обусловливает выраженный клинический эффект в уменьшении симптомов гиперактивности и низкую частоту побочных эффектов. Среди наиболее широко используемых в настоящее время антихолинергических препаратов троспиум и пропиверин обладают наименьшей селективностью. Оксибутинин и солифенацин имеют большее сродство к МЗ-холинорецепторам мочевого пузыря, чем к мускариновым рецепторам второго типа, дарифенацин является МЗ-селективным. Толтеродин демонстрирует приблизительно одинаковое сродство ко всем типам М-холинорецепторов, но при клинических испытаниях оказывал более избирательное действие по отношению к гладким мышцам мочевого пузыря, чем слюнным железам (21,22, 23).
Побочные эффекты М-холиноблокаторов определяются локализацией типов мускариновых рецепторов в различных органах, степенью сродства препаратов к ним и фармакокинетическими параметрами. Сухость во рту, запоры, головная боль и нарушения зрения — наиболее частые нежелательные эффекты М-холинолитиков. Исследование Nilvebrant и соавт. показало, что толтеродин обладает в 8 раз меньшим сродством к М-холинорецепторам слюнных желез, что обусловливает значительно более низкую частоту развития такого побочного эффекта, как сухость во рту (24). При приеме плацебо, толтеродина и оксибутинина возникновение сухости во рту отмечали 15%, 30% и 69% пациентов (25). Оксибутинин быстрого высвобождения чаще вызывает вышеуказанный побочный эффект в сравнении с его медленной и трансдермальной формами, толтерадином, троспиумом и пропиверином. Частота нарушения зрения выше при назначении со лифенацина в дозе 10 мг/день, чем толтеродина быстрого высвобождения 4 мг/день. Риск возникновения запоров был ниже в группе пациентов, получавших толтеродин и оксибутинин трансдермальной формы. Также при употреблении толтеродина быстрого высвобождения и оксибутинина пролонгированной формы в сравнении с другими М-холинолитиками значительно реже возникали диспепсические явления. В целом частота прекращения лечения, обусловленная развитием побочных эффектов, была выше в группе пациентов, получавших оксибутинин быстрого высвобождения (14). Среди редко встречающихся побочных эффектов антимускариновых препаратов следует отметить влияние на сердечно-сосудистую систему, проявляющееся тахикардией и удлинением интервала QT.
Присутствует некоторая озабоченность среди клиницистов относительно того, что антихолинергические препараты, подавляя сокращения волокон детрузора мочевого пузыря, могут таким образом вызывать острую задержку мочи у мужчин с симптомами гиперактивности и сопутствующей инфравезикальной обструкцией. Тем не менее 12-недельное двойное слепое плацебо-контролируемое исследование, целью которого была оценка безопасности применения толтеродина медленной формы высвобождения у мужчин старше 40 лет с уродинамическими доказательствами гиперактивности детрузора и инфравезикальной обструкции, показало, что в группе пациентов, получающих данный препарат, отмечено значительное улучшение показателя максимальной цистометрической емкости. При этом увеличение объема остаточной мочи на 33 мл в сравнении с группой принимавших плацебо не рассматривалось как клинически значимое, риск развития острой задержки мочи был невелик и составил 3% в обеих группах (26).
Поскольку частота ГАМП увеличивается с возрастом, важно, чтобы фармакотерапия была безопасна для пожилых пациентов. Аффинность антихолинергических препаратов к М1-холинорецепторам, вероятно, является одним из ведущих факторов возникновения расстройств в когнитивной сфере, что следует принимать во внимание при назначении того или иного М-холинолитика. Селективность дарифенацина в отношении МЗ-холинорецепторов, низкая липофильность троспиума, что уменьшает вероятность его проникновения через гематоэнцефалический барьер, делают возможным их применение у больных пожилого возраста. Следует отметить, что липофильность толтеродина в 30 раз меньше, чем оксибутинина, поэтому он практически не проникает в ткани головного мозга.
Ряд клинических исследований продемонстрировал, что комбинация антимускариновых препаратов с α-блокаторами эффективна при лечении мужчин с симптомами ГАМП и инфравезикальной обструкцией (27,28). Kaplan S. и соавт. оценили эффективность и безопасность комбинированного применения толтеродина медленного высвобождения и α-блокатора тамсулозина у 879 мужчин, страдающих ГАМП и гиперплазией предстательной железы. После 12-недельного лечения улучшение клинической картины отмечено у 80% пациентов, получавших сочетанную терапию. В группах принимавших только толтеродин медленной формы высвобождения, тамсулозин или плацебо этот показатель составил 65%, 71% и 62% соответственно. Комбинированная терапия показала значительное уменьшение эпизодов недержания и ургентности, числа дневных мочеиспусканий и ноктурии, а также улучшение качества жизни пациентов. Частота острой задержки мочи, потребовавшая катетеризации, при проведении сочетанной терапии была низкой и не превышала 0,4% в сравнении с 0,5% у принимавших толтеродин и 0% у получавших тамсулозин или плацебо (29).
Поскольку частота ГАМП увеличивается с возрастом, важно, чтобы фармакотерапия была безопасна для пожилых пациентов. При назначении М-холиноблокаторов этой категории больных важно учитывать возможность проникновения препаратов через гемато-энцефалический барьер, влияние на функцию печени и почек, взаимодействие с другими лекарственными средствами (30). В тканях головного мозга представлены все 5 типов М-холинорецепторов. Из них наиболее многочисленны мускариновые рецепторы первого типа, локализующиеся в области гиппокампа и коры, которые играют важную роль в процессах памяти и мышления. Таким образом, аффинность антихолинергических препаратов к М1-холинорецепторам, вероятно, является одним из ведущих факторов возникновения расстройств в когнитивной сфере, что следует принимать во внимание при назначении того или иного М-холинолитика (31). Селективность дарифенацина в отношении МЗ-холинорецепторов, низкая липофильность троспиума, что уменьшает вероятность его проникновения через гематоэнцефалический барьер, делают возможным их применение у больных пожилого возраста (32). Следует отметить, что липофильность толтеродина в 30 раз меньше, чем оксибутинина, поэтому он практически не проникает в ткани головного мозга (33,34).
По данным Sand Р. и соавт., которые оценили безопасность и переносимость применения толтеродина медленной формы высвобождения в группах пациенток 64 лет и младше, 65-74 лет, 75 лет и старше, после 12-недельного курса лечения существенной разницы в возникновении побочных эффектов в исследованных возрастных категориях не отмечено (35).
Среди используемых антихолинергических препаратов при лечении детей с симптомами гиперактивности детрузора наиболее изученными являются толтеродин и оксибутинин. Учитывая, что в настоящее время недостаточно данных о возможности применения новых антимускариновых препаратов у детей, необходимо дальнейшее изучение этого вопроса.
Проблема лечения пациентов, страдающих ГАМП, усугубляется низкой комплаентностью. В отношении ГАМП частота прекращения лечения в течение первого года составляет, по данным разных авторов, от 80% до 90%. Менее половины пациентов (32-44%) продолжает прием препаратов больше 30 дней. Среди причин прекращения приема препаратов пациенты указывают низкую эффективность лекарств, необходимость их долговременного употребления, побочные эффекты. В одном из исследований частота прекращения приема препаратов, обусловленная побочными эффектами, составила 7%, б% и 21% в группе получавших плацебо, толтеродин и оксибутинин, соответственно.
Проблема лечения пациентов, страдающих ГАМП, усугубляется низкой комплаентностью, определяемой как среднее число дней между началом терапии и ее прекращением (36). Следует отметить, что высокая частота прекращения лечения является дополнительным барьером в достижении оптимальных исходов при всех хронических состояниях, требующих долгосрочной последовательной терапии. В отношении ГАМП частота прекращения лечения в течение первого года составляет, по данным разных авторов, от 80% до 90%. Менее половины пациентов (32-44%) продолжает прием препаратов больше 30 дней (37, 38). Тогда как среди лиц, страдающих гипертонической болезнью, около 57% продолжают лечение больше года после назначения антигипертензивной терапии (39). Среди причин прекращения приема препаратов пациенты указывают низкую эффективность лекарств, необходимость их долговременного употребления, побочные эффекты. В одном из исследований частота прекращения приема препаратов, обусловленная побочными эффектами, составила 7%, 6% и 21% в группе получавших плацебо, толтеродин и оксибутинин соответственно. В отношении необходимости снижения дозы вследствие неудовлетворительной переносимости этот показатель составил 4%, 7% и 23% пациентов, принимающих плацебо, толтеродин и оксибутинин (25). По данным различных исследований, стоимость медикаментов не является ведущей причиной для прекращения терапии ГАМП (37).
ВЫВОДЫ
Фармакотерапия в лечении пациентов с ГАМП основана на понимании механизмов, вовлеченных в процесс мочеиспускания. В настоящее время М-холиноблокаторы являются препаратами выбора для лечения больных, страдающих симптомами гиперактивности мочевого пузыря. Антихолинергические препараты подтвердили свою эффективность, доказанную многочисленными клиническими исследованиями. Однако отсутствие специфичности в отношении М-холинорецепторов мочевого пузыря, что обусловливает наличие побочных эффектов, остается наибольшим недостатком этой группы. Увеличение уроселективности в будущем может снизить частоту нежелательных эффектов в следующем поколении этого класса лекарственных средств. Кроме М-холинолитиков, обсуждаются возможности применения агонистов альфаЗ-адренорецепторов, ингибиторов фосфодиэстеразы, антагонистов рецепторов нейрокинина-1, опиоидов (40). По мере того как знания в этой области расширяются, необходима разработка новых высокоселективных препаратов, что позволит оптимизировать терапию ГАМП и улучшить качество жизни пациентов.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник