Лучевая терапия простаты мочевой пузырь
Содержание статьи
Лучевая терапия при раке простаты
Лучевая терапия (или радиотерапия) использует высокоэнергетические лучи или частицы для уничтожения раковых клеток. В результате воздействия такой энергии происходит повреждение ДНК клеток, что нарушает их деление. Лучевая терапия может быть использована:
- в качестве первой линии терапии высокодифференцированного рака, который не выходит за пределы простаты. Эффективность (или частота излечения) при данном типе рака сопоставима с таковой у пациентов, которым выполнена радикальная простатэктомия (РПЭ);
- в качестве части первой линии терапии (в сочетании с гормональной терапией) для рака простаты с выходом за пределы и инвазией в близлежащие ткани;
- в качестве второй линии терапии после хирургического лечения, если рак простаты удален не полностью или имеется рецидив рака в ложе удаленной простаты;
- при больших размерах опухоли для ее уменьшения и устранения симптомов заболевания.
Различают основные виды лучевой терапии: дистанционную лучевую терапию (ДЛТ) и брахитерапию. В первом пособии источник излучения находится вне организма человека, во втором — источник излучения помещается в пораженные ткани.
Другой тип лучевой терапии, при котором лекарство с радиоактивными компонентами вводится внутрь организма (в кровь), описан в разделе «Лечение костных метастазов рака простаты».
Дистанционная лучевая терапия (ДЛТ)
При ДЛТ пучки радиоактивной энергии фокусируются на ткани простаты, при этом излучатель находится за пределами организма человека. Используется для излечения рака простаты на ранних стадиях или облегчения симптомов, например, боли в костях.
Перед началом лечения необходимо визуализировать простату и установить ее точное местоположение, например, выполнив МРТ или КТ.
Обычно процедуры радиотерапии проводятся 5 раз в неделю на протяжении 7-9 недель. Как правило, амбулаторно. Излучение во время процедуры сильнее чем при рентгенографии; процедуры безболезненны.
Современные методы ДЛТ позволяют фокусировать излучение более точно на опухоль. Это дает возможность радиологам применять более высокие дозы облучения с одновременным уменьшением воздействия радиации на близлежащие здоровые ткани.
Трехмерная конформная лучевая терапия использует специальные компьютеры для более точного отображения месторасположения простаты. Затем радиационные лучи (пучки) направляются на область простаты с нескольких направлений, что снижает вероятность повреждения нормальных тканей. Метод эффективней стандартной ДЛТ, характеризуется меньшим повреждающим эффектом на окружающие ткани.
Интенсивная модулированная лучевая терапия (ИМЛТ) — это усовершенствованная форма 3D-терапии. Представляет собой машину, управляемую компьютером, которая движется вокруг пациента, создавая излучение. Наряду с генерированием лучей и наведением их на простату под разными углами, возможна также регулировка их интенсивности (силы) для уменьшения дозы облучения наиболее чувствительных нормальных тканей. Это дает возможность врачу увеличить суммарную дозу.
Некоторые современные аппараты для лучевой терапии (ускорители) имеют встроенные системы визуализации. Это новое направление, известное как Лучевая терапия с визуальным контролем, дает возможность врачу получать изображения простаты и доставлять лучевую энергию более прицельно.
Стереотаксическая лучевая терапия (СЛТ) использует технику визуального контроля для доставки большой дозы излучения в точно определенную с помощью компьютера область, например, простату. За счет увеличения однократной дозы облучения, весь курс лечения дается за несколько дней. СЛТ часто обозначается по названию ускорителя, например, Гамма Нож (Gamma Knife®), Рентген-Нож (X-Knife®), Кибернож (CyberKnife®) и Clinac®.
Основное преимущество СЛТ перед ИМЛТ, что лечение занимает меньше времени (дни вместо недель). Количество побочных эффектов, однако, не меньше. Некоторые исследования показали, что некоторые побочные эффекты СЛТ могут быть сильнее, чем при ИМЛТ.
Протонная лучевая терапия
Протонная лучевая терапия использует сфокусированные пучки протонов. В отличие от рентгеновских лучей, которые высвобождают энергию как до, так и после попадания в опухоль (то есть одинаково воздействуют как на нормальные ткани, через которые проходят, так и на опухоль), протоны вызывают небольшое повреждение тканей, через которые проходят, и освобождают свою энергию через определенное расстояние. Пучок протонов может, теоретически, доставить больше радиации на предстательную железу, меньше повреждая нормальные ткани.
Возможные побочные эффекты ДЛТ
Проблемы с кишечником. Раздражение толстого кишечника и прямой кишки, это состояние называется лучевой проктит или сигмоидит. Может приводить к диарее, иногда с примесью крови, а также недержанию кала. Большинство этих проблем проходят, однако в редких случаях нормальная функция кишечника не восстанавливается.
Проблемы с мочевым пузырем. Раздражение мочевого пузыря, состояние называется лучевой цистит. Возникает потребность частого мочеиспускания, резь в мочеиспускательном канале, не исключена примесь крови в моче. Проблемы с мочевым пузырем обычно с течением времени уменьшаются, но в некоторых случаях сохраняются навсегда.
Недержание мочи. Подтекание или подкапывание мочи вне акта мочеиспускания. Как отмечено в секции «Хирургическое лечение», имеются различные степени и виды недержания мочи. Этот побочный эффект встречается значительно реже, чем после хирургии рака простаты.
Эректильная дисфункция (импотенция). Проблемы с эрекций обычно не развиваются сразу, однако медленно прогрессируют. В этом есть отличие от эректильной дисфункции после хирургии простаты, где нарушения эрекции проявляются сразу после операции, а с течением времени возможно улучшение состояния.
Чувство усталости. Сохраняется до нескольких месяцев после лечения.
Лимфедема. Лимфатические узлы в норме обеспечивают отток жидкости от органов к сердцу. Если лимфатические узлы вокруг простаты повреждены в результате воздействия на них радиации, жидкость может накапливаться в ногах и половых органах в течение длительного времени, вызывая отечность и боль. Лимфедема обычно лечится с помощью физических методов (физиотерапевтическое лечение), хотя может и не исчезать полностью. Чтобы узнать больше о лимфедеме, смотрите раздел «Понимание лимфедемы при раке, кроме рака молочной железы».
Стриктура уретры. Уретра (полая трубка, соединяющая мочевой пузырь с внешней средой, проходящая через простату и половой член) повреждается редко, но в последующем может сужаться из-за воздействия радиации. Это может приводить к проблемам с мочеиспусканием, а также потребовать дальнейшего лечения (в том числе оперативного) для восстановления нормального просвета уретры.
Брахитерапия (внутренняя лучевая терапия)
В ходе внутренней лучевой терапии используются радиоактивные гранулы размером с рисовое зерно, которые помещаются непосредственно в простату больного.
Специальные компьютерные программы рассчитывают необходимую дозу. Методы визуализации, такие как трансректальный ультразвук, КТ или МРТ, используются для правильного размещения радиоактивных гранул.
Как правило, брахитерапия применяется на ранних стадиях, когда ожидается медленный рост опухоли. Например, при раке низкой степени злокачественности.
Использование брахитерапии ограничено различными факторами. Риск побочных эффектов высок у мужчин, которым выполнялся ТУР простаты или они имели проблемы с мочеиспусканием.
Большой размер простаты может помешать корректной установке зерен. В этом случае может быть назначен короткий курс гормональной терапии для уменьшения размеров органа.
Существуют 2 типа брахитерапии простаты.
Постоянная (низкодозная) брахитерапия
При этом подходе зерна с радиоактивным материалом (таким как йод-125 или палладиум-103) устанавливаются тонкими иглами через кожу в области между мошонкой и анусом.
Гранулы остаются в простате в течение недель и даже месяцев. Их действие распространяется на очень небольшую площадь вокруг себя. Это помогает сохранить здоровые ткани.
Обычно за одну процедуру устанавливается от 40 до 100 зерен. Поскольку они не причиняют дискомфорт, их не удаляют после потери активности.
Выполняется под спинальной анестезией (обездвиживается нижняя половина тела) или общей анестезии, требует пребывания в стационаре несколько дней.
Брахитерапия может дополняться курсом ДЛТ, если имеется риск распространения рака за пределы простаты.
Временная (или высокодозная) брахитерапия
Этот тип брахитерапии использует более высокие дозы радиации, которые остаются в простате непродолжительное время.
Полые иглы проводят через кожу между мошонкой и анусом в простату. В них помещают мягкие нейлоновые катетеры. Иглу удаляются, а катетеры остаются на какое-то время в простате.
Иридий-192 или Цезий-137 вводятся в катетеры обычно в течение 5-15 минут. В общей сложности требуется около 3 подобных сеансов.
Радиоактивное вещество удаляется из катетеров после каждой процедуры, а катетеры удаляются после последней процедуры.
В стационаре необходимо находиться до 2-3 суток.
После данного лечения в течение недели может ощущаться боль или припухлость в области между мошонкой и анусом, моча может окрашиваться в красно-коричневый цвет.
Данный вид лечения обычно сочетается с ДЛТ, однако доза излучения при ДЛТ в данном случае ниже, чем при выполнении ДЛТ как монотерапии.
Преимущество данного вида лечения в том, что большая часть радиации концентрируется собственно в простате, избавляя от нежелательного воздействия уретру и окружающие простату ткани (нервы, мочевой пузырь, прямую кишку).
Возможный риск и побочные эффекты брахитерапии
Несмотря на то, что радиация распространяется на маленькое расстояние, врач может посоветовать не находиться рядом с беременными женщинами и маленькими детьми некоторое время. Могут быть предложены также другие методы предосторожности, например, обязательное использование презерватива во время секса.
Существует небольшой риск миграции радиоактивных зерен. В течение первых недель могут попросить мочиться в контейнер, чтобы отметить возможное отхождение зерен с мочой.
Имеются единичные данные о возможной миграции зерен через кровь в другие органы, например, в легкие. Однако это клинически не проявляется и случается крайне редко.
Подобно ДЛТ, брахитерапия может вызывать проблемы с кишечником, мочеиспусканием и эрекцией.
Проблемы с кишечником. Боль в прямой кишке, жжение и (или) диарея, могут возникнуть, но длительно сохраняются менее чем в 5% случаев.
Проблемы с мочеиспусканием. Выраженное недержание мочи не является распространенным осложнением брахитерапии. Но у 1 из 3 пациентов может длительно сохраняться учащенное мочеиспускание. Оно бывает вызвано раздражением уретры (мочеиспускательного канала). Редко может происходить сужение (стриктура) уретры, которое в дальнейшем потребует оперативной коррекции.
Проблемы с эрекцией. Часть исследователей считают нарушение эрекции после брахитерапии более редким осложнением, чем после ДЛТ или оперативного лечения, другие наоборот. Чем моложе пациент и лучше сексуальная функция до начала лечения, тем более вероятно восстановление эректильной функции.
Чтобы больше узнать о лучевой терапии, смотрите раздел «Лучевая терапия».
Источник
. —
 05.09.2019
05.09.2019
Англичанину Хансу Шауппу 7 лет назад поставили страшный диагноз: рак предстательной железы в терминальной стадии. То есть в последней, неизлечимой и неизбежно ведущей к смерти. Сейчас Хансу 77 лет, он жив и продолжает работать, управляя собственным бизнесом. Мистер Шаупп стал первым в Великобритании пациентом, получившим новое экспериментальное лечение рака простаты.
«Это настоящая фантастика, — рассказал он английским журналистам. — Терапия не бьет по всему организму, отравляя его, а целится точно в опухолевые клетки. Поэтому я чувствую себя отлично. Побочных эффектов нет».
На недавнем конгрессе Американского общества клинической онкологии в Чикаго эксперты назвали новый подход самым многообещающим методом лечения рака предстательной железы из всех, появившихся за последние 15 лет. Сейчас ведется более 10 клинических исследований по всему миру. То есть пациенты, как Ханс Шаупп, получают терапию экспериментально, официально этот способ лечения еще не одобрен. В чем заключается прорыв и насколько оправданны надежды? Об этом мы спросили одного из ведущих российских онкоурологов, заместителя директора Института урологии и репродуктивного здоровья человека Сеченовского университета, члена аблятивной группы Европейского общества по урологическим технологиям (абляция — это удаление новообразований предстательной железы при помощи лазера. — Ред.), члена редколлегии ведущего американского урологического журнала Current Opinion in Urology Дмитрия Еникеева.
ВЫЧИСЛИТЬ ВРАГА
— Речь идет о лечении метастатического рака простаты. То есть рака предстательной железы, который уже вышел за пределы органа и дал метастазы, в том числе отдаленные, — поясняет Еникеев. — Такой рак называют «запущенным». Малоинвазивные операции, то есть с минимальным вмешательством, уже невозможны. Существующее лечение, в том числе лучевая терапия, в таких ситуациях действует не только на ткани простаты и метастазы, но и на близлежащие органы. Могут быть повреждены кишечник, мочевой пузырь и другие органы. Новый вид терапии нацелен на решение этой проблемы.
Появился он не на пустом месте. «В основе нового лечения лежит один из самых передовых методов диагностики, который используется сейчас для выявления рецидивов рака простаты, — рассказывает эксперт. — Это ПЭТ с ПСМА, то есть позитронно-эмиссионная томография с контролем по простатспецифическому мембранному антигену». ПСМА — белок, который содержится в клетках предстательной железы. При раке простаты его уровень увеличивается. Фармпрепарат, применяемый при диагностике, связывается с ПСМА, накапливается в клетках предстательной железы и метастазов, делая их заметными при сканировании.
ТОЧНО В ЦЕЛЬ
Новый вид лечения называется ПСМА-радиотерапией.
— Суть в том, что к простат-специфическому мембранному антигену прикрепляют радионуклеид Лютеций-177, — говорит Дмитрий Еникеев. — Раствор вводится внутривенно, раз в две недели. ПСМ-антиген, как мы знаем, накапливается всеми клетками простаты, включая злокачественные клетки метастазов. И вместе с ПСМА в метастазах накапливается Лютеций-177. При облучении радионуклеид прицельно уничтожает метастазы, не задевая здоровые ткани других органов.
— В здоровых клетках простаты тоже есть ПСМА, значит, Лютеций-177 накапливается и там? То есть облучение полностью уничтожает ткани простаты?
— Да, фактически происходит то же, что и при малоинвазивном хирургическом лечении, которое сейчас возможно только на ранних стадиях, когда рак не вышел за пределы предстательной железы. ПСМА-радиотерапия способна помогать на поздних, запущенных стадиях. При этом пациенты, участвующие в клинических исследованиях, зачастую сообщают, что серьезных побочных эффектов не чувствуют. Качество жизни ощутимо не страдает.
Однако слишком обольщаться тоже не стоит, предупреждает доктор Еникеев. Положительный эффект лечения на сегодня отмечается у 40 — 60% пациентов, то есть в среднем у каждого второго. При этом удается продлевать жизнь в среднем на 13,3 месяцев, а у 20% пациентов (каждого пятого) — на 33 месяца и более.
Клинические исследования продолжаются, а ученые работают над усовершенствованием терапии.
А КАК У НАС?
Россия сейчас не входит в число стран, где ведутся клинические исследования ПСМА-радиотерапии.
В то же время в нашей стране, как и во всем мире, в повседневную практику входит малоинвазивное лечение рака простаты.
— На сегодня Институт урологии и репродуктивного здоровья человека Сеченовского университета — один из немногих центров Европы, где используются практически все существующие методики лечения локализованного рака простаты, — рассказывает Дмитрий Еникеев. — Помимо классической хирургии, в том числе с использованием робота Да Винчи, применяются все малоинвазивные способы. Такие как: брахитерапия (то есть имплантация в простату радиоактивных источников), криоабляция (лечение рака простаты методом глубокой заморозки), HIFU-терапия (уничтожение рака простаты высокочастотным ультразвуком).
— Также в Институте применяется методика МРТ-фьюжн биопсии. Она позволяет увеличить частоту выявления рака простаты и провести его фокальное лечение (то есть прицельное воздействие только на опухоль с сохранением здоровой ткани простаты и окружающих тканей. — Ред.). Именно фокальная терапия во всем мире считается одной из наиболее перспективных методик лечения рака на ранних стадиях. Идея технологии — лечение не всей простаты, а только участка, пораженного раком. Исследование по применению такой терапии с использованием методики нанонож идет в нашем институте с 2018 года. Первые результаты, полученные после операций, выглядят многообещающими.
СОВЕТ ВРАЧА
Самое важное, что сейчас можно и нужно делать каждому мужчине — проходить скрининги для раннего выявления рака предстательной железы, говорит онкоуролог Дмитрий Еникеев. Врачи рекомендуют сдавать анализ крови на уровень ПСА (простатспецифический антиген), начиная с 45 лет. Далее — с периодичностью, которую определит доктор после первого осмотра, в среднем — раз в год.
— Повышенный уровень ПСА сам по себе не означает, что вас отправят на операцию или будут делать биопсию (изъятие ткани для проверки на наличие опухолевых клеток. — Ред.), — подчеркивает доктор Еникеев. — Это повод для углубленного обследования и оценки большого количества самых разных факторов — от объема простаты до возраста пациента. В том числе возможны ситуации, когда с учетом возраста пациента и состояния его организма врач принимает решение вообще никак не вмешиваться. Поскольку все условия говорят о том, что развитие опухоли не будет критичным и не окажет существенного влияния на качество и срок жизни пациента.
Возврат к списку
Источник
Лечение рака мочевого пузыря
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последнего поколения с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название — переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа — уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1-2% случаев (по данным Американского онкологического сообщества — American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев — аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев — мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы — злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N — наличие очагов поражения в регионарных лимфоузлах, M — наличие отдаленных метастазов в других органах.

В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 — неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии — это инвазивный рак.
- Стадия I — опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II — опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III — злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1-3), отдаленных метастазов нет (M0).
- Стадия IV — злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
Важно внимательно относиться к своему здоровью, обращать внимание на любые симптомы, которые сохраняются в течение длительного времени, и при их возникновении сразу обращаться к врачу.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
- Цитологическое исследование мочи — её изучение под микроскопом на предмет наличия опухолевых клеток. Этот анализ иногда помогает диагностировать рак на ранних стадиях, но он не идеален.
- Исследование мочи на онкомаркеры — вещества, повышение уровней которых может свидетельствовать о злокачественной опухоли. Это также не совсем надежный тест.
- Цистоскопия — эндоскопическое исследование мочевого пузыря, когда в орган вводят специальный инструмент — цистоскоп — с видеокамерой. Наиболее информативна так называемая цистоскопия с синим светом. В мочевой пузырь вводят специальный препарат, который накапливается в опухолевых клетках и заставляет их флуоресцировать («светиться») в лучах синего света.
- Биопсия — исследование, во время которого получают фрагмент патологически измененной ткани и изучают в лаборатории под микроскопом. Это самый надежный способ разобраться, присутствуют ли в патологическом образовании раковые клетки, и является ли оно злокачественным. Материал для биопсии можно получить во время цистоскопии.
- Внутривенная пиелография. Пациенту внутривенно вводят раствор рентгеноконтрастного препарата, который затем начинает выводиться почками и «прокрашивает» мочевыводящие пути на рентгеновских снимках. Это помогает обнаружить опухоли.
- Ретроградная пиелография — исследование, во время которого рентгеноконтрастный раствор вводят через катетер, установленный в мочевом пузыре или мочеточнике.
- Ультразвуковое исследование помогает оценить размеры опухоли, выяснить, не распространилась ли она за пределы мочевого пузыря, проверить состояние почек. Под контролем УЗИ в обнаруженную опухоль можно ввести иглу и провести биопсию.
- Компьютерная томография и МРТ помогают оценить размеры, расположение, количество опухолевых очагов, обнаружить распространение рака на соседние органы, в лимфатические узлы, выявить метастазы. Под контролем КТ также можно провести биопсию с помощью иглы.
- Рентгенографию применяют для поиска метастазов в легких, костях.
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Как выбирают лечение при раке мочевого пузыря?
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
Хирургическое лечение
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент — резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
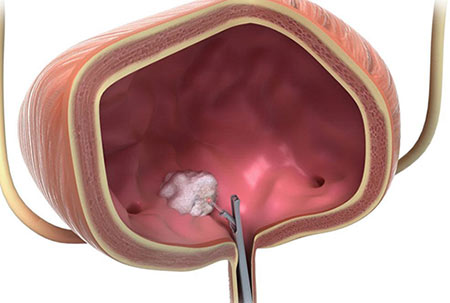
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию — удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.
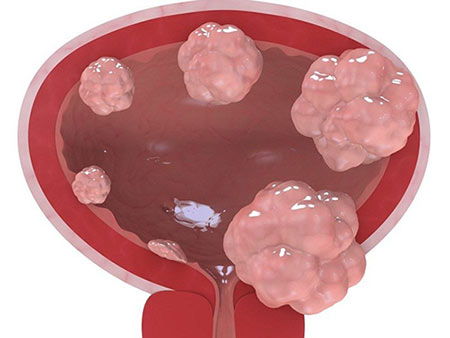
Большинству больных приходится выполнять цистэктомию — полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин — семенные пузырьки и простату, у женщин — матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения — когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция — когда хирург подсоединяет к одному концу кишки мочеточники, а к другому — мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиотерапия
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
- Неоадъювантную химиотерапию проводят до хирургического вмешательства. Благодаря препаратам опухоль уменьшается, и ее становится проще удалить.
- Адъювантная химиотерапия применяется после операции. Если в организме пациента остались раковые клетки, химиопрепараты их уничтожают, за счет этого снижается риск рецидива.
- Химиолучевая терапия — когда химиопрепараты назначают «в помощь» лучевой терапии. За счет этого повышается эффективность лечения рака.
- Паллиативная химиотерапия — один из основных методов лечения на поздних стадиях, когда опухоль неоперабельна, имеются отдаленные метастазы. Химиопрепараты помогают продлить жизнь пациента и избавить от некоторых симптомов.
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.
Лучевая терапия
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Иммунотерапия рака мочевого пузыря
Иммунитет человека умеет уничтожать не только болезнетворные микроорганизмы, проникшие извне, но и собственные клетки, в генах которых возникли «ошибки». Именно из-за таких «ошибок» нормальная клетка превращается в раковую. Однако, опухолевые клетки умеют «обманывать» иммунитет, и используют для этого сложные молекулярные механизмы.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2-3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10-15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса — для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухоли, состояния здоровья пациента, наличия и отсутствия у него противопоказаний.
Оптимальные методы лечения злокачественных опухолей мочевого пузыря прописаны в специальных документах — протоколах. Они составлены на основе результатов многочисленных клинических исследований с участием тысяч пациенто?