Лучевая терапия белок в моче
Содержание статьи
Восстановление почек после химиотерапии
Восстановление почек после химиотерапии — важнейшая задача, потому что недостаточность функции мочевыделительной системы не только портит качество жизни, но и сокращает её продолжительность даже при хорошем результате противоопухолевого лечения. Раннее обнаружение негативных последствий со стороны почек позитивно сказывается на лечении рака.
Как химиотерапия вредит почкам
Полностью предотвратить поражение почек во время химиотерапии невозможно, тем не менее, негативные последствия стараются минимизировать специальными методиками введения нефротоксичных цитостатиков. Химиопрепараты способны уничтожить любую клетку, если у неё слаба система личной защиты. Быстрорастущие ткани делают ставку на скорость деления клеточной популяции, а не на устойчивость клеток к лекарственному воздействию — при массовой гибели клеток они быстро производят новые. По такому принципу живет злокачественная опухоль, слизистые оболочки, кровь и половые железы, поэтому больше остальных тканей страдают от химиотерапии.
Почка состоит из миллионов нефронов. Каждый нефрон имеет фильтрующий кровь клубочек, образующаяся при этом первичная моча идёт по системе канальцев, выделяющих в мочу ненужные и всасывающие назад очень нужные вещества. Весь нефрон выстлан изнутри эпителием, нестойким к воздействию цитостатиков. Большинство лекарственных средств с помощью нефрона выводятся из крови в мочу, что ставит почку под двойной удар химиотерапии.
Способствуют развитию патологии почек возрастные изменения и повышенное давление, избыточный вес и метаболические нарушения, курение и алкоголь, растет частота повреждения почечной паренхимы рентгенологическими контрастными веществами. Заболевания почек часто протекают скрытно для пациента, без целенаправленного обследования обнаружить их невозможно.
Химиопрепараты преимущественно повреждают ткань почки и реже — её сосуды, некоторые цитостатики, как цисплатин, портят все структуры.
Нефропатией называют любую болезнь почки, которая может выражаться повреждением разных её структур, для нефротоксичности характерны такие заболевания:
- гломерулопатия — воспаление клубочка с типичными «почечными» отеками, изменением анализа мочи и уремией — задержкой в крови токсичных продуктов жизнедеятельности при применении бисфосфонатов и интерферона;
- интерстициальная нефропатия — повреждение нефронов и тканей между ними возникает на фоне цисплатина, метотрексата и таргетных препаратов сунитиниба и сорафениба, эффективных при почечно-клеточной карциноме;
- тубулопатия — изменения мембран клеток почечных канальцев с нарушением процессов выделения и поглощения веществ из первичной мочи типично для таргетных препаратов и цитостатиков, так цисплатин обуславливает избыточную потерю натрия и магния с белками при задержке глюкозы, циклофосфан не дает возвращаться отвечающему за водно-электролитный обмен гормону.
Не выявленная нефропатия при продолжении химиотерапии способна привести к острому нарушению функции почек, которое до 2004 года называли «острой почечной недостаточностью», а в настоящее время обозначают как острое почечное повреждение (ОПП), или к хронической болезни почек — современному синониму хронической почечной недостаточности.
Хроническая болезнь почек (ХБП) протекает без явной манифестации — без характерных симптомов, а часто и вовсе без каких-либо клинических признаков, и обнаруживается, как правило, при обследовании мочевыделительной системы. Для постановки диагноза хронической почечной недостаточности довольно выявить что-то одно:
- нарушение функциональных возможностей в виде стойкого, неоднократно констатированного снижения минутной скорости клубочковой фильтрации (СКФ) ниже 90 миллилитров при эталонной площади поверхности тела в 1.73 квадратных метра;
- методами лучевой диагностики (КТ, МРТ) констатировать необратимое изменение формы и структуры почки, например, её сморщивание;
- при микроскопии биопсированного кусочка почечной ткани найти признаки поражения почечной паренхимы;
- неоднократно на протяжении трёх месяцев в анализе мочи находить избыточное количество белка.
По степени снижения СКФ хроническая болезнь почек разделяется на пять стадий, начиная с 1 «оптимальной» с СКФ >90 мл/мин/1.73 М² до 5 «терминальной почечной недостаточности» с СКФ <15. Стадия 3 имеет две подстадии — «а» с умеренно и «б» существенно сниженной скоростью фильтрации. Гемодиализ начинается при 4 стадии хронической болезни почек.
Симптомы острого почечного повреждения развиваются очень быстро — буквально в считаные дни и обусловлены накоплением в крови не удаляемых отключенными нефронами продуктов жизнедеятельности и задержкой жидкости.
Диагноз ОПП устанавливается быстро, потому что этого требует прогрессивное ухудшение состояния пациента, достаточно выявить только один признак из списка:
- снижение выделения мочи ниже 500 мл в сутки или анурию — полное прекращение мочеотделения;
- значительное повышение креатинина крови за последние двое суток;
- полуторакратное повышение концентрации креатинина в крови за неделю.
По уровню выделяемой мочи и показателям анализов выделяют 3 степени ОПП. У пациента отмечается прогрессирующее ухудшение состояния с симптомами отравления и декомпенсации органов: отеки, рвота, судороги, изменение сознания и дезориентация вследствие отека головного мозга, нарушения дыхания вплоть до отека легких, аритмии и скачки давления, кровотечения. От пациента исходит запах мочи, легко присоединяется инфекция. При отсутствии адекватной реанимационной помощи возможна смерть, при неправильном лечении в дальнейшем не исключена хроническая болезнь почек.
Способы восстановления почек после химиотерапии
Всем пациентам до начала нефротоксичной химиотерапии необходимо определять функциональные возможности почек и во время лечения контролировать анализы.
Замечено, что однократное использование цисплатина в стандартной дозе, как правило, проходит благополучно, даже при поражении нефрона к началу следующего цикла ткань почек восстанавливается. С ростом числа введений вероятность повреждения растёт, а при суммарном получении более 850 мг цисплатина хроническая недостаточность более чем реальна.
Произошедшую цисплатиновую нефропатию вылечить невозможно, но применение антидота в процессе химиотерапии помогает предотвратить развитие ОПП и ХБП без влияния на результативность противоопухолевого лечения.

При выявлении лекарственного повреждения почек решается вопрос о продолжении противоопухолевого лечения, в некоторых случаях необходимо снизить дозы препаратов при регулярном использовании капельных введений растворов для очищения плазмы и поддержания баланса электролитов. Состав капельниц определяется биохимическими анализами крови, а точнее, концентрацией белковых фракций, микроэлементов и электролитов. Аллопуринол помогает удалить из плазмы избыток мочевой кислоты. В большинстве случаев активная парентеральная терапия на фоне высоких доз мочегонных препаратов способствует восстановлению и поддержанию функциональных возможностей почечной паренхимы.
При развитии в процессе противоопухолевого лечения ОПП 3 степени пострадавшему пациенту проводится гемодиализ, очищающий кровь от продуктов жизнедетельности и цитостатика. Диализ удаляет из плазмы крови цисплатин и карбоплатин, гемцитабин, этопозид и циклофосфан, но не «осевшие» в тканях антрациклины и винкаалкалоиды. Гемодиализ эффективно борется с нефропатией, у большинства пациентов предотвращая возможность развития хронической недостаточности.
Как правило, лекарственная ХБП развивается через несколько лет после завершения противоопухолевого лечения. При хронической почечной недостаточности лечение также ориентируется на содержание веществ в плазме крови, до 4 степени ограничиваются капельными вливаниями разнообразных растворов, к гемодиализу прибегают при существенном снижении фильтрации.
Огромную роль в восстановлении почечной функции играет образ жизни и питание. Необходимо отказаться от алкоголя и курения, снизить употребление соли и добиться снижения избыточного веса. Нарушение почечной фильтрации требует ограничения пищевого белка, что не помогает восстановлению остальных тканей, поврежденных цитостатиками, поэтому адекватный рацион, покрывающий все потребности организма — нутритивная поддержка должна рассчитываться специалистом.
Никакими народными способами невозможно избавить организм от последствий лекарственной нефротоксичности, прием мочегонных травок и травяных сборов приводит к обезвоживанию и ещё более выраженному дисбалансу микроэлементов.
Как избежать отказа почек после химиотерапии?
Побочные эффекты цитостатической терапии можно только предполагать, прогнозировать их невозможно. Выраженность нефротоксичности зависит от суммарной дозы цитостатика и индивидуальных особенностей пациента: наличия у него гипертонии или диабета, заболеваний сердца и аутоиммунной патологии, врожденных аномалий мочевыделительной системы или последствий гинекологических болезней, избыточного веса и гепатита. Всё это должно учитываться при планировании лечения, а текущее состояние органов и развивающиеся последствия определяются при обследовании.
Что нужно сделать, какое исследование провести, какие маркеры почечного повреждения определить и как изменить диету — расскажут специалисты Европейской клиники.
Список литературы
- Громова Е. Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. /Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов // Злокачественные опухоли: Практические рекомендации RUSSCO; 2017 (том 7).
- Громова Е. Г., Ларионова В. Б. Снеговой А. В. /Практические рекомендации по лечению органной недостаточности в процессе лекарственного противоопухолевого лечения у онкологических больных// Злокачественные опухоли; 2016, № 4. Спецвыпуск 2.
- Кучер А.Г., Каюков И.Г., Григорьева Н.Д., Васильев А.Н. /Лечебное питание на различных стадиях хронической болезни почек// Нефрология и диализ 2007; 9(2).
- Perazella M.A. /Drug-induced renal failure: up on new medications and unique mechanisms of nephrotoxicity // Am J Med Sci.; 2003 Vol. 325.
- Rha S.Y., Moon Y.H., Jeung H.C., et al./ Gemcitabine monotherapy as salvage chemotherapy in heavily pretreated ic breast cancer// Breast Cancer Res Treat; 2005, 90.
- Sirohi B., Arnedos M., Popat S., et al. /Platinum-based chemotherapy in triple negative breast cancer// Ann Oncol; 2008, 19.
- Schiepati A., Remuzzi G. /Chronic renal disease as a public health problem: Epidemiology, and economic implications//Kidney Int; 2005; 68[Suppl 98].
Источник
Лучевой цистит
Лучевой цистит — это реакция тканей мочевого пузыря на ионизирующее облучение, проводимое в рамках лечения злокачественных опухолей малого таза. Симптомы зависят от полученной лучевой нагрузки, варьируются от незначительного дискомфорта при мочеиспускании, частых позывов и микрогематурии до выраженных болей, появления рецидивирующего кровотечения, угрожающего жизни. Диагноз подтверждают с помощью общего анализа мочи, цистоскопии. Лечение пострадиационного цистита определяется степенью выраженности поражения, может быть консервативным или оперативным с выполнением цистэктомии, решением вопроса с отведением мочи.
Общие сведения
Лучевой цистит регистрируют у 5-21% пациентов как осложнение лучевой терапии. Наиболее часто симптомы появляются после лечения рака мочевого пузыря (18%), простаты (14%), шейки матки (5%). Патология развивается в среднем через 32 недели после лечения, у мужчин чаще, чем у женщин (2,8:1). Конформная лучевая терапия, брахитерапия сопряжены с меньшей вероятностью возникновения пострадиационного цистита по сравнению с обычной. Но даже при таком лечении случайное облучение близлежащих тканей неизбежно из-за проникновения новообразования в окружающие органы или из-за близости рака к соседним структурам таза.
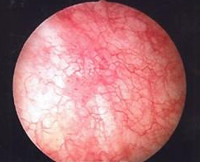
Лучевой цистит
Причины
Во время лучевой терапии происходит передача энергии ионизирующего излучения молекулам опухолевых клеток и тканям соседних органов, в частности — мочевому пузырю, прямой кишке. В результате альтерации нарушается трофика, кровоснабжение, позднее развиваются фиброзно-склерозирующие изменения. Пострадиационный цистит вызывает прохождение лучевой терапии по поводу опухолей:
- предстательной железы;
- влагалища, матки, ее шейки, яичников;
- мочевого пузыря;
- толстой, прямой кишки.
Определенное значение имеют локализация новообразования, стадия болезни, ежедневная и суммарная доза облучения (количество сеансов), тип лучевой терапии. К способствующим циститу факторам относятся:
- общее снижение иммунной реактивности организма на фоне злокачественного новообразования;
- выполненное оперативное вмешательство, например, трансуретральная резекция (ТУР) простаты или стенки пузыря с опухолью;
- одновременное прохождение химиотерапии;
- урологические заболевания: сопутствующий воспалительный процесс, цистолитиаз, дивертикулы;
- патологии, предрасполагающие к плохому заживлению, локальной ишемии: СПИД, сахарный диабет, болезни сосудов;
- ожирение (ИМТ >30 кг/м2);
- проведение гормонального лечения по поводу рака простаты;
- хроническая никотиновая интоксикация (≥1 пачки в день).
Патогенез
Радиация взаимодействует с внутриклеточной жидкостью, в результате высвобождаются свободные радикалы, нарушающие синтез ДНК, что приводит к гибели клеток. На фоне терапии повреждаются мембраны как раковых, так и здоровых клеток, изменения затрагивают сосуды. Субэндотелиальная пролиферация, отек постепенно истощают кровоснабжение облученной зоны. Неоваскуляризация, неадекватная регенерация провоцируют формирование хрупких поверхностных сосудов, ответственных за макрогематурию при геморрагическом цистите.
Отложение коллагена запускает процессы рубцевания, способствует дальнейшей облитерации кровеносных сосудов, вследствие чего развивается гипоксия, некроз. В мочевом пузыре на фоне ишемии слизистой оболочки повреждается уротелий, что вызывает подслизистый фиброз, поскольку субэпителиальные ткани подвергаются едкому воздействию мочи. Образование язв, поражение нервов, пострадиационный фиброз обеспечивают появление развернутой клинической симптоматики.
Классификация
Лучевой цистит может быть ранним, возникающим в течение 4 недель или 6-12 месяцев после терапии, и поздним, с появлением симптомов спустя год или позже. Выделяют острое и хроническое течение пострадиационного воспаления. Специалисты в сфере онкоурологии используют в работе специальную шкалу для оценки степени выраженности изменений мочевого пузыря, подвергшегося лучевому воздействию:
- 1 степень подразумевает незначительную эпителиальную атрофию и расширение сосудов, обнаружение единичных эритроцитов в моче. Клинические проявления чаще отсутствуют.
- 2 степень характеризуется обнаружением множественных телеангиэктазий, эпизодами макрогематурии. Мочеиспускание учащено, появляются жалобы на недержание урины.
- 3 степень представлена видоизменением сосудов по всей поверхности, формированием микроциста (уменьшением емкости органа), стойким недержанием мочи, изнурительными позывами на мочевыделение до 40 эпизодов в сутки, включая ноктурию, рецидивирующей макрогематурией.
- 4 степень при цистоскопии обнаруживаются участки некротизации, признаки тотального геморрагического цистита с участками петехий, емкость пузыря при тугом наполнении менее 100 мл, отмечается полная утрата контроля над мочевыделением, требующая вспомогательных мер (катетеризации или цистэктомии). В моче постоянно присутствует кровь, белок, слущенный эпителий.
- 5 степень наиболее неблагоприятна в прогностическом плане, гематурия приводит к развитию угрожающей жизни анемии, формированию свищей. Определяется максимально выраженный болевой синдром, высокий риск летального исхода.
Симптомы лучевого цистита
Сразу или через несколько недель после одномоментного получения значительной дозы радиации развивается острый воспалительный процесс. Как правило, ранний цистит является самоограниченным, симптомы аналогичны острому инфекционному воспалению, включают рези при учащенном мочеиспускании и после, боли внизу живота, ургентные позывы на мочевыделение. Может присутствовать кровь в моче, но более типична микрогематурия. Отмечается хороший ответ на терапию.
Лучевой цистит, возникший спустя несколько месяцев либо лет после лечения, может проявляться постоянной дизурией, сильной болью, позывами к мочеиспусканию через каждые 10-15 минут из-за формирования микроциста, выделением урины с кровью, стойкой инконтиненцией. Макрогематурия приобретает рецидивирующий характер, обнаруживается значительная кровопотеря. Повышение температуры свидетельствует о вторичном бактериальном инфицировании.
Осложнения
Лучевой цистит осложняется присоединением инфекции с развитием бактериального воспалительного процесса в почках (пиелонефрит в 20%), прогрессирующим уменьшением емкости или рубцовым сморщиванием органа и неоплазией (менее 2%), образованием свища (2%), контрактуры шейки (3-5%). При выраженном пострадиационном воспалении возникает некупируемый хронический болевой синдром, значительно ухудшающий качество жизни.
Кровотечению из видоизмененных сосудов (геморрагический цистит в 3-5%) нередко сопутствует анемия, иногда частота и выраженность кровотечения настолько значительна, что требуется проведение цистэктомии, поскольку неоднократные коагуляции лишь усугубляют фиброзно-склеротический процесс. Гематурия может сопровождаться образованием сгустков, которые приводят к острой задержке мочеиспускания за счет гемотампонады уретры.
Диагностика
Прохождение лечения с использованием ионизирующего облучения с отсроченным появлением типичных жалоб — основной критерий, на основании которого врач-уролог выставляет предварительный диагноз лучевого цистита. Учитывая то, что данные симптомы могут свидетельствовать о ряде других патологических процессов, показано прохождение углубленного клинико-урологического обследования, которое включает:
- Лабораторные анализы. В ОАМ обнаруживают микро- или макрогематурию, белок, эпителий, иногда бактерии, лейкоциты. Бакпосев производят для исключения инфекции мочевыводящих путей. Цитология мочи обоснована при подозрении на рак мочевого пузыря. В результатах анализа крови обращают внимание на гемоглобин, гематокрит, уровень тромбоцитов. Коагулограмма позволяет исключить нарушения в работе свертывающей системы.
- Инструментальную диагностику. Основным исследованием является цистоскопия, которая позволяет исключить другие причины жалоб, например, камень или мочепузырную опухоль. Типичная картина — множественные телеангиэктазии на фоне отечной слизистой, на продвинутой стадии — множественные эрозии. Прочие методы визуализации (МРТ, КТ, экскреторную урографию) назначают для исключения свищей, других причин гематурии.
- Биопсию стенки пузыря. Морфологическое исследование проводят после получения неоднозначных результатов УЗИ, цистоскопии и КТ или МРТ при высокой вероятности опухолевого процесса. Перед выполнением биопсии учитывают потенциальный риск кровотечения из поверхностных сосудов в результате травматизации.
Дифференциацию осуществляют между уроцистолитиазом, распространением опухоли из малого таза в пузырь, прогрессированием рака, сопровождающегося кровотечением, болевым синдромом. КТ и МРТ становятся основными диагностическими процедурами в данной клинической ситуации.
Лечение лучевого цистита
Терапевтические мероприятия зависят от выраженности процесса, в каждом случае определяются индивидуально. Первая и вторая степени цистита после облучения требуют активной тактики только при наличии жалоб. Цистэктомия рассматривается как крайний вариант для лечения постлучевого цистита, выполняется при безуспешности консервативной терапии.
Медикаментозное лечение
Радиационно-индуцированная гематурия может быть легкой или опасной для жизни, во втором случае прибегают к реанимационным мероприятиям, переливанию компонентов крови. Перечень препаратов для лечения включает:
- антихолинергические средства;
- обезболивающие агенты;
- фибринолитики;
- лекарства, улучшающие кровообращение;
- альфа-1-адреноблокаторы.
Инстилляции в мочевой пузырь
Вливание растворов — следующий этап лечения при неэффективности пероральной терапии лучевого цистита и налаженной системы орошения. Используют следующие препараты:
- Гиалуроновая кислота. Мукополисахарид, присутствующий в соединительной и эпителиальной тканях, ингибирует образование иммунных комплексов, нейтрализует функции нейтрофилов при регуляции пролиферации фибробластов, эндотелиальных клеток. Аналогичным действием обладает хондроитин-сульфат.
- Аминокапроновая кислота. Стабилизирует процесс свертывания крови путем фибринолиза.
- Формалин. 1% раствор является тканевым фиксатором, который денатурирует поверхностный слой уротелия, обеспечивая гемостаз. Лечение сопровождается сильной болью, что требует назначения анальгетиков. Высок риск побочных эффектов.
- Соли алюминия. 1% сульфат алюминия-аммония или сульфат алюминия-калия вызывают осаждение белка на поверхности клеток и в интерстициальных пространствах, что позволяет прекратить кровоточивость.
- Плацентарный экстракт. Эффективен в эпителизации эрозий, язв.
Хирургическое лечение
Если консервативная терапия и внутрипузырные инстилляции не могут остановить кровотечение, прибегают к различным эндоскопическим или чрескожным вмешательствам. Цистоскопия с фульгурацией проблемных участков, эвакуация кровяного сгустка, выполнение электрокоагуляции являются разумными шагами в дальнейшей тактике. Виды вмешательств при лучевом цистите:
- Введение ботулинического токсина А. Препарат вводится в стенку мочевого пузыря при отсутствии эффекта от антихолинергических средств. Лечение направлено на увеличение емкости пузыря, снижение частоты мочеиспускания, купирование ургентных позывов.
- Наложение чрескожного нефростомического дренажа. Отведение мочи из ЧЛС почек способствует регенерации уротелия нижних отделов мочевого тракта. Через 3-6 месяцев восстанавливают анатомически правильный отток урины.
- Эндоскопическая склеротерапия. Введение склерозанта в кровоточащие области эффективно не в 100% случаев, но у большинства пациентов с трудноизлечимым геморрагическим циститом обеспечивает снижение выраженности симптоматики, гемостаз.
- Эмболизация сосудов. Помогает остановить кровотечение при рефрактерном пострадиационном геморрагическом цистите.
- Паллиативная цистэктомия. Органоуносящая операция показана при рецидивирующей гематурии при безуспешности всех видов лечения, формировании свища, микроцисте (объем менее 200 мл) с изнуряющими позывами на мочеиспускание, стойком болевом синдроме. Урину отводят путем создания кондуита толстой кишки или выполнения двусторонней транскутанеостомии.
Физиотерапия
Гипербарическая кислородная терапия (оксигенация) способствует нормализации ангиогенеза, мобилизации стволовых клеток, остановке кровотечения за счет активации процессов фибринолиза, разрешению ишемии. Используется как дополнительный способ лечения лучевого цистита. Проведение оксигенобаротерапии не имеет каких-либо неблагоприятных последствий.
Прогноз и профилактика
Лучевой цистит, развившийся через 4-6 недель от начала сеансов ЛТ, имеет более благоприятный прогноз. Улучшение наступает примерно через 1,5 месяца, но у 5-20% процесс переходит в стойкую форму с рецидивирующими клиническими проявлениями через несколько месяцев или даже 10-20 лет. Хронические формы менее благоприятны.
Профилактика подразумевает выбор типа лучевой терапии с максимальным воздействием на опухоль, но не на соседние ткани, выполнение инстилляций на основе гиалуроновой кислоты с превентивной целью, прием растительных диуретиков. Исследования показали уменьшение симптомов цистита при использовании добавок, содержащих клюквенный экстракт.
Источник