Лейкоплакия мочевого пузыря или плоскоклеточная метаплазия
Содержание статьи
Лейкоплакия мочевого пузыря (Лейкокератоз мочевого пузыря, Лейкоплазия мочевого пузыря)
Лейкоплакия мочевого пузыря — это метаплазия (перерождение) уротелия в многослойный плоский эпителий, иногда с кератинизацией. Симптомы могут отсутствовать, иногда патология клинически проявляется учащенным с дискомфортом мочеиспусканием, ургентными позывами, синдромом хронической тазовой боли. Диагностика подразумевает цистоскопию с биопсией, окончательная верификация выполняется с помощью морфологического исследования. Лечение может быть консервативным — антибиотики, средства, улучшающие кровообращение, витамины, инстилляции или оперативным — направленным на ликвидацию патологических очагов.
Общие сведения
Лейкоплакия (лейкокератоз, лейкоплазия) мочевого пузыря встречается в 1:10 000 случаев. Сам термин подразумевает перерождение нормального переходного эпителия в патологический, нетипичный для слизистых — многослойный ороговевающий плоскоклеточный. Впервые состояние описано в 1862 году австрийским патологом К. Рокитанским, который обратил внимание на избыточное образование клеток с явлениями десквамации. Это наиболее опасный тип лейкоплакии, так как кератинизация либо сопутствует карциноме мочевого пузыря, либо имеет риск озлокачествления. Некератинизированный тип лейкоплакии встречается у женщин и маленьких детей (редко) и не представляет опасности.
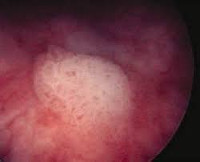
Лейкоплакия мочевого пузыря
Причины
Патогенез и этиология до настоящего времени остаются дискутабельными. Некоторые практики считают лейкоплакию мочевого пузыря гистологическими изменениями ткани при длительно существующем (более 2 лет) хроническом цистите с эпизодами рецидивирования. К состояниям, которые рассматривают в качестве возможных причин, относят:
- Хронические очаги инфекции в организме. В основном, это воспалительные заболевания тазовых органов, которые инициированы специфической (хламидия, микоплазма, герпес, ВПЧ) и неспецифической микрофлорой (кишечная палочка, стрептококк, протей). Патогены могут попадать в пузырь не только восходящим, но и гематогенным путем: из матки, кишечника, почек, кариозных зубов или миндалин. Рецидивирующий цистит рассматривается, как основная причина лейкоплакии.
- Эндокринные нарушения. Исследования показывают, что у пациенток с лейкоплакией менархе наступает позднее, в дальнейшем присутствуют нарушения менструальной функции: менометроррагия, бесплодие, нерегулярные ановуляторные циклы. Прием некоторых оральных контрацептивов способствует развитию гипоэстрогении, на фоне которой переходный эпителий мочевого пузыря заменяется многослойным плоским.
- Травмирующие факторы. Установленные искусственные дренажи, их замена, бужирование уретры приводят к постоянной травматизации и провоцируют метаплазию уротелия. В литературе встречаются данные о развитии лейкоплакии мочевого пузыря после оперативного лечения, лучевого воздействия, при цистолитиазе.
- Дистрофические нарушения. Нарушение кровоснабжения и иннервации стенки мочевого пузыря препятствует нормальной трофики органа. Ишемия нарушает состав муцинового слоя. Слизистая становится более рыхлой, что предрасполагает к внедрению бактерий и вирусов. Запоры, малоподвижный образ жизни, варикозное расширение вен малого таза — факторы, способствующие конгестии и недостаточной трофике тканей.
Нерациональный прием некоторых препаратов, курение, хронический алкоголизм и гиповитаминоз А с фоновой иммуносупрессией относят к факторам риска, способствующим атипичной дифференцировке клеток. В тропических странах метаплазия сопутствует шистосомозу ‒ паразитарному заболеванию, при котором яйца гельминтов могут находиться в мелких сосудах мочевого пузыря (мочеполовой шистосомоз).
Патогенез
Воспаление и другие этиофакторы вызывают нарушение общих и местных реакций иммунной системы, из-за чего на слизистой оболочке персистирует инфекционная и условно-патогенная микрофлора. Стойкое инфицирование, процессы альтерации и репарации приводят к метаплазии и фиброзу. В многослойном плоском эпителии, который является результатом нарушения цитодифференцировки, отсутствует гликогенобразование, и в ряде наблюдений возникает ороговение.
Моча оказывает раздражающее действие на видоизмененные клетки, оставшиеся без естественной защиты (утрата антиадгезивного фактора позволяет микробам задерживаться), что поддерживает воспаление и вызывает болевые ощущения, даже если была проведена адекватная антибактериальная терапия. Через разрушенный слой также происходит миграция ионов калия из мочи в интерстиций, что вызывает деполяризацию нервных окончаний, спазм гладкой мускулатуры, альтерацию кровеносных и лимфатических сосудов. Эти механизмы обеспечивают стойкую дизурию.
Классификация
Участки лейкоплакии могут быть единичными, но в тяжелых случаях белесые бляшки занимают значительную область мочевого пузыря. В формировании лейкоплакии выделяют 3 стадии: плоскоклеточная модуляция, плоскоклеточная метаплазия и присоединение кератинизации (ороговения). В зависимости от гистологических особенностей рассматривают:
- Некератинизированный подтип лейкоплакии. Встречается в области мочепузырного треугольника (также называется псевдомембранозным тригонитом), вариант нормы. Изменения регистрируют преимущественно у женщин, связи с химическими и физическими раздражителями нет, как и риска малигнизации. При появлении симптомов лечится эстрогенами.
- Кератинизированный подтип лейкоплакии. Патология чаще встречается у мужчин, связана с механическим воздействием. При ряде наблюдений регистрируют атипию, поэтому кератинизирующий подтип является фактором риска плоскоклеточного рака.
Учитывая то, что лейкоплакия мочевого пузыря — диагноз преимущественно гистологический, выставляемый на основании морфологического исследования, в практической урологии пользуются классификацией по стадиям — от этого зависит тактика ведения пациента. Выделяют три стадии патологического процесса:
- 1 стадия. Для нее характерны метапластические изменения переходного эпителия, которые не видны при выполнении цистоскопии и подтверждаются исключительно гистологически. Количество клеточных слоев увеличено в 2 раза, типично изменение формы верхних слоев (полигональная), пузырькообразные ядра с множественными ядрышками. Гистохимия показывает избыточное количество гликогена и прокератина.
- 2 стадия. Происходит дальнейшее видоизменение эпителия, что можно наблюдать при цистоскопии в виде беловатого или желтоватого налета на слизистой мочевого пузыря. Очаги единичные. Гистологическая картина представлена метапластическим многослойным плоским эпителием с типичной вертикальной дифференцировкой. Нижние слои составляют мелкие гиперхромные полигональные клетки, верхние клетки крупнее в размерах, содержат кератогиалин.
- 3 стадия. Процесс генерализуется, происходит распространение очагов лейкоплакии с вовлечением практически всей слизистой оболочки. Гистологические характеристики идентичны. Воспалительные изменения — утолщение стенок, отек, расширение и ломкость сосудов выражены значительно.
Симптомы
На 1 стадии какие-либо проявления отсутствуют, по мере прогрессирования заболевания появляются жалобы на затрудненное мочеиспускание с резями (53%), постоянные ноющие боли внизу живота (80%), непреодолимые позывы помочиться с недержанием урины (14%). Выраженный болевой синдром свидетельствует либо о тотальном поражении, либо о лейкоплакии шейки мочевого пузыря, особенно богатой нервными окончаниями.
При распространенном процессе симптомы могут быть настолько изнурительными, что значительно страдает качество жизни. Частота позывов на мочеиспускание даже ночью может достигать 5-6 раз в час. Поллакиурия присутствует у 83-95% больных. В запущенных случаях пациенты предъявляют жалобы на появление крови в моче в конце акта мочевыделения (терминальная гематурия), изменение ее качеств — нередко в осадок выпадают белые хлопья, лейкоциты, бактерии. Страдает психоэмоциональная сфера, присоединяются раздражительность, бессонница, подавленное настроение.
Осложнения
У 10-20% больных лейкоплакия мочевого пузыря с кератинизацией протекает с карциномой. Почти всегда на 3 стадии у женщин присоединяется диспареуния — болезненные ощущения при сексуальном контакте, ухудшение симптоматики после половой близости встречается у большинства пациенток. У мужчин лейкоплакия мочевого пузыря сопровождается эректильной дисфункцией. Фоновая рецидивирующая инфекция мочевыводящих путей выявляется практически у всех пациентов.
Рецидивирующий воспалительный процесс приводит к замещению нормальной функциональной ткани на фиброзную, что нарушает нормальное мочевыделение (нейрогенная дисфункция) и приводит к постоянному присутствию остаточной мочи. Неадекватное опорожнение становится причиной образования рефлюкса и пиелонефрита у трети пациентов, присоединения хронической почечной недостаточности в каждом пятом случае и цистолитиаза в 22-35%. Еще одно осложнение лейкоплакии — уменьшение емкости мочевого пузыря (микроцист) при частом мочевыделении и атрофии мышц.
Диагностика
Специфических изменений в общем анализе мочи, которые позволили бы однозначно подтвердить диагноз лейкоплакии мочевого пузыря, нет. Лечением патологии занимается специалист-уролог, при присоединении осложнений может быть полезна консультация нефролога, андролога. Алгоритм исследований при лейкоплакии может быть следующим:
- Лабораторная диагностика. В моче часто повышено количество лейкоцитов, бактерий, эритроцитов, могут присутствовать отслоившиеся чешуйки. Информативна ПЦР-диагностика на ИППП. Дополнительно выполняют культуральное исследование — посев мочи на питательные среды с целью определения возбудителей и чувствительности к лекарствам. У женщин исследуют гормональный профиль (эстрадиол, прогестерон, ФСГ).
- Инструментальная диагностика. Золотой стандарт — цистоскопия, во время которой в мочевом пузыре видны участки лейкоплакии. Из подозрительных мест берут образцы ткани для последующей морфологии, именно она позволяет верифицировать диагноз. УЗИ почек и органов малого таза назначают для уточнения состояния близлежащих структур и оценки возможных осложнений.
Дифференциальную диагностику проводят с циститом грибковой этиологии, для которого также характерны белесые налеты на слизистой органа. Похожая цистоскопическая картина наблюдается при малакоплакии — редком заболевании неизвестной этиологии с появлением желтоватых или беловатых бляшек, иногда с изъязвлениями. При мочеполовом туберкулезе и амилоидозе с помощью с помощью оптики можно увидеть очаги, которые напоминают лейкоплакию.
Лечение лейкоплакии мочевого пузыря
У женщин с некератинизированным подтипом лейкоплакии в отсутствие жалоб проводится динамическое наблюдение, при появлении неблагоприятной симптоматики назначают эстрогены. Лечение лейкоплакии с ороговением может быть на начальных стадиях консервативным (с обязательным наблюдением), далее рекомендован хирургический подход. В клинической практике применяется:
- Медикаментозное лечение. Назначают антибиотики с учетом чувствительности, противовирусные и противовоспалительные средства, иммуномодуляторы. На незапущенных стадиях хороший терапевтический эффект можно получить после инстилляций препаратов на основе гликозаминогликанов. При сопутствующем цистите в мочевой пузырь вводят антисептические растворы, масла с противовоспалительным и витаминизирующим действием, обезболивающие препараты.
- Физиотерапия. В качестве физиотерапевтического воздействия в составе комплексной терапии применяется магнитотерапия, электрофорез, лазеро- и микроволновая терапия. При физиотерапевтических сеансах уменьшается выраженность воспаления, улучшается трофика (что особенно актуально при лейкоплакии, связанной с дистрофическими нарушениями), повышается концентрация препарата в патологическом участке.
- Оперативное лечение. На 2-3 стадии выполняют хирургическое лечение. ИЛТ (интерстициальная лазерная терапия) и ТУР мочевого пузыря (трансуретральная резекция) — щадящие операции при лейкоплакии. При ИЛТ вероятность присоединения осложнений меньше. Цистэктомия в настоящее время выполняется редко и только при обширном поражении.
Прогноз и профилактика
Прогноз зависит от стадии заболевания и подтипа лейкоплакии, при отсутствии кератинизации он благоприятный. При лейкоплакии с кератинизацией на 1-2 стадии прогноз удовлетворительный при своевременном обращении, поддерживающем лечении и регулярном наблюдении с целью раннего выявления возможной малигнизации. На продвинутой стадии после успешно выполненного хирургического лечения исход относительно благоприятный. К инвалидизации пациента и социальной дезадаптации приводит распространенная форма заболевания с развитием осложнений.
Профилактика подразумевает своевременное обращение к урологу при первых симптомах неблагополучия со стороны органов мочеполовой сферы, адекватное лечение воспалительной патологии, отказ от вредных привычек, рациональный прием препаратов. Учитывая, что цистит ‒ основной патогенетический фактор в развитии лейкоплакии ‒ может вызываться ИППП, целесообразно придерживаться моногамных отношений или использовать барьерные средства защиты при случайных половых контактах.
Источник
Плоскоклеточная метаплазия уротелия – диагностика, лечение и прогноз: взгляд онколога
 | Александр Константинович Носов К.м.н., зав. отделением онкоурологии ФГБУ НИИ онкологии им. Н. Н. Петрова Минздрава России (Санкт-Петербург) nakuro@yandex.ru |
Сергей Александрович Рева К.м.н., врач-онкоуролог отделения онкоурологии ФГБУ НИИ онкологии им. Н. Н. Петрова Минздрава России (Санкт-Петербург) sgreva79@mail.ru |
На сегодняшний день диагностика, лечение и оценка прогноза при лейкоплакии мочевого пузыря до сих пор вызывают разногласия среди специалистов. Одни авторы под термином «лейкоплакия» понимают плоскоклеточную метаплазию с кератинизацией (D. B. Connery, 1953), другие — плоскоклеточную метаплазию уротелия в целом, выделяя различные тактику лечения и прогноз в зависимости от формы (Б. П. Матвеев, 2011). Некоторые авторы рассматривают плоскоклеточную метаплазию без кератинизации и кератинизирующую метаплазию как стадии одного процесса (А. И. Неймарк и др., 2003). В абсолютном большинстве случаев плоскоклеточная метаплазия представлена изменениями без кератинизации (R. H. Young, 2008), кератинизирующая форма относится к нечастым состояниям и выявляется в 1 случае на 10 тыс. всех госпитализаций в урологический стационар (D. B. Connery, 1953).
Типичная картина, характерная для плоскоклеточной метаплазии, — определяемое при цистоскопии белесоватое бархатистое пятно в области треугольника Льето. Такие изменения могут быть выявлены у 80 % здоровых женщин, что в 4 раза превышает встречаемость у мужчин. В зарубежн ых руководствах это рассматривается как норма, а в России часто становится поводом для применения инвазивных методов лечения. Отечественные мультимедийные источники, зачастую не имеющие отношения к медицине, трактуют любую форму плоскоклеточной метаплазии как заболевание, предрасполагающее к развитию рака мочевого пузыря, и рекомендуют агрессивный подход в лечении лейкоплакии.
Кератинизирующая метаплазия уротелия
На начальном этапе развития плоскоклеточная метаплазия является адаптивным и протективным механизмом, защищающим стенку мочевого пузыря от агрессивного внешнего воздействия (K. M. Denlay et al., 1999). При этом не исключается спонтанное восстановление уротелия. Классически плоскоклеточная метаплазия подразделяется на кератинизирующую и некератинизирующую (Б. П. Матвеев, 2011). Четкое описание кератинизирующей плоскоклеточной метаплазии (КПМ) было предложено McDonald, описавшим это состояние как «ороговение неороговевающей мембраны». Некоторые авторы считают КПМ предраковым состоянием, особенно при массивном поражении мочевого пузыря (F. V. Alonso et al., 2012). Первый случай карциномы мочевого пузыря, развившейся при длительном наблюдении за пациентом с КПМ, был описан в 1961 г. Holley и Mellinger. Позднее в работах других авторов была выявлена связь КПМ и плоскоклеточного рака с хронической (особенно шистосоматозной) инфекцией (M. S. Khan et al., 2002).
Цистоскопическая картина характеризуется белесоватыми бляшками на фоне гиперемированной слизистой, расположенными в любом месте мочевого пузыря или диффузно, с преимущественной локализацией в области устьев мочеточников и по передней стенке мочевого пузыря. Проникновение мочи в подлежащий бляшке подслизистый слой может служить причиной поддержания воспалительных изменений в стенке мочевого пузыря, что было подтверждено данными электронной микроскопии (R. G. Morgan et al., 1980). Гистологически очаги поражения представляют собой сквамозный эпителий различной толщины, покрытый слоем кератина, и напоминают карциному in situ (R. H. Young, 2008). Очаги поражения могут быть четко отделены или сливаться с окружающей слизистой мочевого пузыря. В диагностике и прогнозе КПМ в последнее время вызывают интерес различные маркеры (EGFR, PPRAy, PTEN, FOXA1 и т. д.), однако их диагностическая ценность требует дальнейшего подтверждения. Считается, что риск развития плоскоклеточной карциномы при КПМ составляет от 21 до 42 %. Время от диагностирования метаплазии до верифицирования рака мочевого пузыря может варьировать от 4 до 28 лет, а в 9-22 % случаев плоскоклеточный рак развивается синхронно с метаплазией (M. S. Khan et al., 2002). Авторы, проводившие исследование среди 78 больных с КПМ, сообщили о синхронном выявлении карциномы мочевого пузыря и метаплазии у 21 % больных и выявлении рака после диагностирования метаплазии при средней продолжительности 11 лет в 20 % случаев (R. C. Benson et al., 1984). Результатом другого исследования стал вывод о том, что КПМ является предраковым процессом с риском злокачественной трансформации при объеме поражения мочевого пузыря более 50 % и длительном течении (M. S. Khan et al., 2002). Выявлена связь КПМ с формированием сморщенного мочевого пузыря, развитие переходноклеточной или недифференцированной карциномы предполагает плохой прогноз (R. W. Reece et al., 1975). В случае сморщивания мочевого пузыря и при прогрессировании заболевания пациенту может быть предложена цистэктомия (M. S. Khan et al., 2002). Пятилетняя специфическая выживаемость составляет в этих случаях в среднем 57 %.
Одни авторы сообщают о возможности химиопрофилактики КПМ (A. L. Cheng et al., 2001), другие сомневаются в ее эффективности (R. Torrisi et al., 2000). Антибактериальные препараты могут приводить к регрессу симптомов в трансформированной слизистой, но не к объективным изменениям, поэтому наиболее рациональным методом представляется трансуретральная резекция участков при ограниченной площади поражения (F. V. Alonso et al., 2012).
Пациенты, находящиеся на интермиттирующей катетеризации, должны подвергаться мониторингу в целях выявления КПМ.
Наиболее распространенные схемы предлагают проведение ежегодной цистоскопии и цитологического исследования мочи с периодическим выполнением рандомных биопсий (А. И. Неймарк и др., 2003).
Некератинизирующая метаплазия уротелия
НПМ уротелия — наиболее частая трансформация слизистой мочевого пузыря. НПМ известна как «вагинальная метаплазия», так как эпителий при исследовании напоминает влагалищный, и практически всегда выявляется у женщин репродуктивного возраста в области мочепузырного треугольника. Основное отличие от КПМ — отсутствие клеточной атипии, что позволяет рассматривать данные изменения как вариант нормальной слизистой, развивающийся вследствие гормональной активности эстрогенов и не имеющий клинической значимости (C. C. Guo et al., 2006). Такие изменения присутствуют у 86 % женщин в репродуктивном возрасте и почти у 75 % в постменопаузальном периоде (T. J. Stephenson et al., 1989; E. D. Long et al., 1983). Данный тип эпителия очень редко выявляется у мужчин, но может быть обнаружен у пациентов, получающих терапию эстрогенами по поводу аденокарциномы предстательной железы, что подтверждает гормональную природу описанных трансформаций уротелия (L. Henry et al., 1971). Некоторые авторы сообщают, что НПМ не должна ассоциироваться с КПМ, так как развивается в результате гормональных изменений и является вариантом нормального течения процесса перестройки эпителия (R. H. Young et al., 2008). На сегодняшний день нет данных о стадийных изменениях слизистой мочевого пузыря и развитии ороговевающей формы метаплазии из неороговевающей, нет свидетельств предракового характера НПМ.
Лабораторная диагностика часто не приносит результатов. В работе F. C. Burkhard et al. (2004) только у 15 % больных был выявлен инфекционный возбудитель и у 30 % определялась лейкоцитурия. При цистоскопии выявляются белесоватые очаги в шейке мочевого пузыря.
В случае сочетания НПМ с симптомами нижних мочевых путей необходимость локального лечения метаплазии остается спорной. Пациентки проходят длительную медикаментозную терапию, диагноз выставляется после смены множества антибактериальных препаратов, схем мочепузырных инстилляций и т. д. Тем не менее в ряде исследований показана высокая эффективность консервативного лечения. Так, среди пациентов с клинически диагностированной лейкоплакией была отмечена эффективность доксициклина (отсутствие или уменьшение симптомов) в 71 % случаев (F. C. Burkhard et al., 2004). Авторы подчеркнули роль хронической инфекции и необходимость лечения полового партнера, который может быть бессимптомным носителем.
Тактика наблюдения за пациентами при НПМ заключается в периодических цистоскопиях с биопсией слизистой или без нее, так как отмечаются случаи сочетания ороговевающих и неороговевающих участков у одного пациента (A. Kasianandan et al., 2012).
Методы лечения и прогноз
Таким образом, КПМ считается предраковым состоянием, при котором необходимо тщательное наблюдение вследствие вероятного злокачественного потенциала и возможных последствий прогрессирования кератинизации мочевого пузыря. При ограниченном по объему поражении наиболее эффективным методом лечения на сегодняшний день считается трансуретральная резекция. НПМ относится к одному из вариантов нормального строения уротелия и развивается в результате гормональных изменений в организме, не является предраковым состоянием и не требует хирургического лечения.
Основной вопрос, вызывающий дискуссии у большинства авторов, — это возможная связь стойкой дизурии у женщин с очагами НПМ. К настоящему моменту убедительных доказательств такой связи нет. Пациенткам с очагами НПМ необходимо тщательное уродинамическое обследование и, возможно, лечение гиперактивности мочевого пузыря. Доказательств эффективности купирования дизурии при локальном инвазивном лечении очагов НПМ не выявлено.
Юрий Владиславович Кудрявцев Д.м.н., врач-патологоанатом, проф. кафедры патологической анатомии ПМГМУ им. И. М. Сеченова, зав. патологоанатомическим отделением Госпиталя для ветеранов войн № 2 kuv50@mail.ru |
Проблема плоскоклеточной метаплазии уротелия является недостаточно изученной. Так, существуют некоторые разногласия в понимании процессов трансформации слизистой оболочки, их классификации, остаются открытыми вопросы диагностики и прогноза. Важные акценты по данной теме расставил д.м.н., проф. кафедры патологической анатомии Первого МГМУ им. И. М. Сеченова Юрий Владиславович Кудрявцев.
— Среди специалистов существуют разногласия в понимании термина «лейкоплакия» и соответствующих процессов в уротелии. Одни ученые рассматривают метаплазию в целом, представляя некератинизирующую плоскоклеточную ме та плазию (НПМ) и кератинизирующую плоскоклеточную ме та плазию (КПМ) в качестве последовательных стадий одного процесса. По мнению других исследователей, НПМ является вариантом нормальной слизистой, не имеющим клинической значимости, а к лейкоплакии следует относить только КПМ. Какова Ваша точка зрения на эту проблему?
— Говоря о лейкоплакии, мы всегда имеем в виду исключительно плоскоклеточную метаплазию, и не более того. Это состояние относится к группе общепатологических (компенсаторно-приспособительных) процессов и является ответной реакцией на изменяющиеся условия внешней среды (относительно клеточного пула, но не макроорганизма).
— О каких условиях идет речь?
— Это могут быть бактериурия, изменение pH мочи, хроническое воспаление, склероз, гормональный дисбаланс, конкременты, раздражающие и травмирующие слизистую оболочку, и т. д. Важно отметить, что мы говорим о стадийности единого процесса. Сначала развивается неороговевающая форма плоскоклеточной метаплазии, потом — ороговевающая (т. е. собственно лейкоплакия), далее крайняя степень гиперкератоза — сквамозный, другими словами, слущивающийся вариант.
— Ранее даже употреблялся термин «эпидермизация» применительно к слизистой оболочке мочевого пузыря, не так ли?
— Да, при микроскопии наблюдаются клетки, напоминающие кожный покров. После увеличения количества клеточных элементов (гиперплазии) происходит их уплощение и вытяжение параллельно базальной мембране (трансформация переходного эпителия или уротелия в плоскоклеточный); затем начинается активный синтез кератина, и можно обнаружить кератогиалин либо внутри клеток (некератинизирующая метаплазия), либо вне клеток (кератинизирующая метаплазия).
— Что можно увидеть при эндоскопии?
— Выявляется либо очаг белесоватого цвета, либо большое количество чешуек во взвешенном состоянии, что иногда называют «фибринозным циститом». Слущивающиеся пластинки при гиперкератозе дают видимость плавающих белесоватых структур в моче.
— Что Вы можете сказать о лабораторной диагностике?
— Лабораторной диагностики метаплазии не существует. Проводятся только цистоскопия и гистологическое исследование. Цистоскопия информативна лишь в стадии ороговения.
— Во всех ли случаях при подозрении на лейкоплакию уротелия (при цистоскопическом исследовании) показана биопсия? Как Вы к ней относитесь?
— Да, биопсия показана во всех случаях и всегда. Она нужна прежде всего для исключения фокусов дисплазии в очаге лейкоплакии. Отношение к биопсии положительное.
— Какое место отводится неопластическим процессам в описанной Вами системе?
— Любое неадекватное воздействие приводит к соответствующей реакции со стороны мочевого пузыря (его слизистой оболочки). Данный компенсаторно-приспособительный процесс выражается в гиперплазии (сначала очаговой, затем — тотальной или диффузной). После этого процесс может развиваться в двух направлениях. Первый путь — слизистая оболочка приспосабливается к повреждающему фактору, т. е. развивается плоскоклеточная метаплазия. Второй путь — слизистая оболочка трансформируется в сторону дисплазии, что, в свою очередь, приводит через 1-3 стадии дифференцировки к карциноме in situ и в конечном итоге к инфильтративному раку.
— На какой стадии метаплазии может произойти инициация диспластического процесса?
— На фоне метаплазии, безусловно, может возникнуть диспластический процесс; более того, неопластические процессы могут наблюдаться как при КПМ, так и при НПМ.
— У многих здоровых женщин может быть выявлена плоскоклеточная метаплазия. При этом зачастую говорится о необходимо сти ее лечения как предракового состояния мочевого пузыря. Что, на Ваш взгляд, является патологией и вариантом нормы?
— Плоскоклеточная метаплазия в любом случае — патология. Но при этом абсолютно неправильно говорить, что лейкоплакия или плоскоклеточная метаплазия в целом являются предраковыми состояниями. Они представляют лишь способ существования слизистой оболочки — протективный механизм.
— В чем суть этого явления?
— К примеру, рассмотрим вариант со склеротическими изменениями подслизистого слоя собственной пластинки. Они приводят к неадекватному питанию слизистой оболочки в силу нарушений механизмов доставки питательных веществ. Как следствие, слизистая оболочка переходит на энергетически менее затратный способ существования — из уротелия возникает плоскоклеточный эпителий (напомним, что метаплазия — это развитие другой ткани в рамках одного гистогенетического ростка).
— В чем, с Вашей точки зрения, должно заключаться лечение?
— Терапия должна быть направлена на активный поиск и ликвидацию причины, вызвавшей метаплазию, но отнюдь не на сам эпителий. Более того, стоит убрать раздражающий фактор — и все вернется в нормальное состояние, включая диспластические процессы. Наш ведущий онкоморфолог Дмитрий Иванович Головин еще в начале 1970-х годов говорил, что карцинома in situ обратима (в отличие от инфильтративного рака, когда разрушена базальная мембрана).
— Исходя из этой логики, подлежат ли участки лейкоплакии радикальному удалению?
— Нет, не подлежат.
— Постановка диагноза метаплазии (особенно при сочетании с симптомами нижних мочевых путей) часто происходит после смены различных антибактериальных препаратов (что приводит к формированию резистентности микрофлоры и т. д.). Какова, на Ваш взгляд, роль инфекционных возбудителей в развитии метаплазии? Какое влияние антибактериальная терапия оказывает на трансформированную слизистую оболочку?
слизистую оболочку? — Инфекционный возбудитель — это лишь один из травмирующих факторов, с которым нужно бороться. Грамотная антибактериальная терапия эффективна в рамках воздействия на конкретного возбудителя и влияет на него, а не на трансформированную слизистую оболочку. На мой взгляд, наиболее опасную роль в развитии плоскоклеточной метаплазии играют внутриклеточные паразиты (хламидии, уреаплазма и т. д.), инициирующие скрытый, вялотекущий, малозаметный воспалительный процесс, который сложно увидеть и распознать.
— Что Вы думаете о применении различных маркеров в диагностике и определении прогноза метаплазии?
— Метаплазия — это изменение типа ткани. И наша задача — доказать, что это не порок развития, т. е. не эмбриопатия. Для этого мы применяем любой иммуногистохимический маркер переходного эпителия (из которого под внешним воздействием, путем трансформации, возникает плоский эпителий). Если мы хотим доказать факт начала диспластического процесса (путь малигнизации), нужно сопоставить маркеры апоптоза и пролиферации (p53 и Ki-67). При этом снижение p53 говорит о слабой ингибиции онкогенов (их дестабилизации), но не о наличии карциномы как таковой; рост Ki-67 говорит о высокой степени репродукции ДНК, что не всегда связано с озлокачествлением (а, например, может характеризовать процессы репарации).
— Могут ли встречаться случаи сочетания ороговевающих и неороговевающих участков у одного пациента?
— Да, такие случаи встречаются, и достаточно часто; метаплазия может носить как очаговый, так и диффузный характер; при этом, как правило, присутствует гетерогенность изменений.
Беседовал Андрей Трофименко
Источник