Комбинированное лечение рака мочевого пузыря
Содержание статьи
Лечение рака мочевого пузыря
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последнего поколения с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название — переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа — уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1-2% случаев (по данным Американского онкологического сообщества — American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев — аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев — мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы — злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N — наличие очагов поражения в регионарных лимфоузлах, M — наличие отдаленных метастазов в других органах.

В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 — неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии — это инвазивный рак.
- Стадия I — опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II — опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III — злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1-3), отдаленных метастазов нет (M0).
- Стадия IV — злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
Важно внимательно относиться к своему здоровью, обращать внимание на любые симптомы, которые сохраняются в течение длительного времени, и при их возникновении сразу обращаться к врачу.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
- Цитологическое исследование мочи — её изучение под микроскопом на предмет наличия опухолевых клеток. Этот анализ иногда помогает диагностировать рак на ранних стадиях, но он не идеален.
- Исследование мочи на онкомаркеры — вещества, повышение уровней которых может свидетельствовать о злокачественной опухоли. Это также не совсем надежный тест.
- Цистоскопия — эндоскопическое исследование мочевого пузыря, когда в орган вводят специальный инструмент — цистоскоп — с видеокамерой. Наиболее информативна так называемая цистоскопия с синим светом. В мочевой пузырь вводят специальный препарат, который накапливается в опухолевых клетках и заставляет их флуоресцировать («светиться») в лучах синего света.
- Биопсия — исследование, во время которого получают фрагмент патологически измененной ткани и изучают в лаборатории под микроскопом. Это самый надежный способ разобраться, присутствуют ли в патологическом образовании раковые клетки, и является ли оно злокачественным. Материал для биопсии можно получить во время цистоскопии.
- Внутривенная пиелография. Пациенту внутривенно вводят раствор рентгеноконтрастного препарата, который затем начинает выводиться почками и «прокрашивает» мочевыводящие пути на рентгеновских снимках. Это помогает обнаружить опухоли.
- Ретроградная пиелография — исследование, во время которого рентгеноконтрастный раствор вводят через катетер, установленный в мочевом пузыре или мочеточнике.
- Ультразвуковое исследование помогает оценить размеры опухоли, выяснить, не распространилась ли она за пределы мочевого пузыря, проверить состояние почек. Под контролем УЗИ в обнаруженную опухоль можно ввести иглу и провести биопсию.
- Компьютерная томография и МРТ помогают оценить размеры, расположение, количество опухолевых очагов, обнаружить распространение рака на соседние органы, в лимфатические узлы, выявить метастазы. Под контролем КТ также можно провести биопсию с помощью иглы.
- Рентгенографию применяют для поиска метастазов в легких, костях.
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Как выбирают лечение при раке мочевого пузыря?
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
Хирургическое лечение
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент — резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
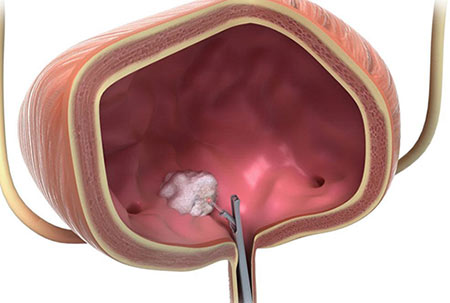
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию — удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.
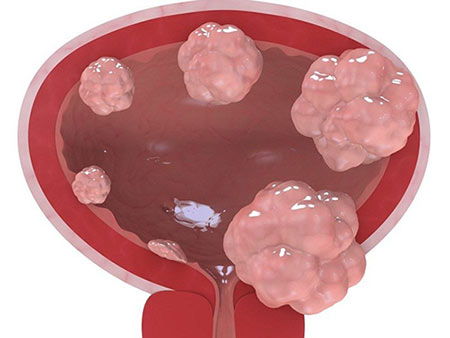
Большинству больных приходится выполнять цистэктомию — полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин — семенные пузырьки и простату, у женщин — матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения — когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция — когда хирург подсоединяет к одному концу кишки мочеточники, а к другому — мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиотерапия
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
- Неоадъювантную химиотерапию проводят до хирургического вмешательства. Благодаря препаратам опухоль уменьшается, и ее становится проще удалить.
- Адъювантная химиотерапия применяется после операции. Если в организме пациента остались раковые клетки, химиопрепараты их уничтожают, за счет этого снижается риск рецидива.
- Химиолучевая терапия — когда химиопрепараты назначают «в помощь» лучевой терапии. За счет этого повышается эффективность лечения рака.
- Паллиативная химиотерапия — один из основных методов лечения на поздних стадиях, когда опухоль неоперабельна, имеются отдаленные метастазы. Химиопрепараты помогают продлить жизнь пациента и избавить от некоторых симптомов.
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.
Лучевая терапия
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Иммунотерапия рака мочевого пузыря
Иммунитет человека умеет уничтожать не только болезнетворные микроорганизмы, проникшие извне, но и собственные клетки, в генах которых возникли «ошибки». Именно из-за таких «ошибок» нормальная клетка превращается в раковую. Однако, опухолевые клетки умеют «обманывать» иммунитет, и используют для этого сложные молекулярные механизмы.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2-3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10-15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса — для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухоли, состояния здоровья пациента, наличия и отсутствия у него противопоказаний.
Оптимальные методы лечения злокачественных опухолей мочевого пузыря прописаны в специальных документах — протоколах. Они составлены на основе результатов многочисленных клинических исследований с участием тысяч пациентов по всему миру и регулярно пересматриваются, обновляются.
Врачи в Европейской клинике руководствуются последними версиями американских, европейских, израильских протоколов лечения.
Насколько эффективны современные методы лечения, каков прогноз?
В среднем в течение 5 лет остаются в живых 77% пациентов, в течение 10 лет — 70%, в течение 15 лет — 65%. Пятилетняя выживаемость при злокачественных опухолях мочевого пузыря зависит от стадии:
- Стадия 0-98%.
- Стадия I-88%.
- Стадия II-63%.
- Стадия III-46%.
- Стадия IV-15%.
В настоящее время проводятся клинические исследования, врачи ищут более эффективные способы борьбы с заболеванием, а значит, есть надежда, что в ближайшем будущем эти показатели улучшатся.
Источник
Опыт применения фотодинамической терапии в комбинированном лечении поверхностного рака мочевого пузыря
© М. Н. Слесаревская, А. В. Соколов
Цель исследования: Целью исследования явилась оценка эффективности применения фотодинамической терапии вместе с трансуретральной резекцией при лечении 36 больных поверхностным раком мочевого пузыря. В качестве фотосенсибилизатора использовали фотодитазин в средней дозе 0,8 мг/кг массы тела. Время экспозиции составляло от 12 до 48 минут. Рецидивирование опухолевого процесса в первые 12 месяцев после проведенного лечения отмечено только у 4 (11,1 %) больных, что расценено как положительный результат.
Ключевые слова: поверхностный рак мочевого пузыря, фотодинамическая терапия, фотодитазин.
Введение
Рак мочевого пузыря (РМП) является актуальной проблемой онкоурологии. Это связано, прежде всего, с высокими показателями заболеваемости и смертности от данной патологии. Ежегодно в мире регистрируют до 200 тыс. новых случаев РМП. В России в 2009 году выявлено 13 260 новых случаев РМП у мужчин, стандартизованный показатель заболеваемости составил 12,18 на 100 тыс. мужского населения. У женщин в 2009 году отмечено 2828 случаев РМП, стандартизованный показатель заболеваемости составил 1,82 на 100 тыс. женского населения [3].
РМП характеризуют прогрессирующее течение и склонность к рецидивированию. В качестве стандартного опера тивного вмешательства при лечении поверхностного РМП в настоящее время рассматривают транс уретральную резекцию стенки мочевого пузыря (ТУР). Однако вероятность возникновения рецидива опухоли после ТУР достаточно высока и в среднем составляет 50 %, при этом примерно половина рецидивов развиваются в течение первого года после операции [1, 11]. Рецидивы после трансуретральной резекции поверхностного РМП выявляют у 30 % больных при наличии одиночной опухоли и у 90 % пациентов при мультифокальном поражении мочевого пузыря [10]. Прогрессирование заболевания и развитие мышечно-инвазивного РМП отмечено у 15 % больных с опухолями стадии Та и у 33 % больных с опухолями стадии Т1. В зависимости от размера опухоли прогрессирование регистрируют в 10 % случаев при опухолях менее 3 см и в 35 % — при размерах опухоли более 3 см [4, 5]. В связи с высокой частотой возникновения рецидивов и прогрессирования поверхностного РМП полное излечение пациентов представляется весьма трудной задачей. В связи с этим важное значение приобретают мероприятия, направленные на профилактику рецидивов опухолевого процесса после ТУР. Основными направлениями адъювантного лечения являются внутрипузырная химиотерапия, иммунотерапия, фотодинамическая терапия (ФДТ), позволяющие уменьшить вероятность рецидивирования РМП в среднем на 20 % [2, 6].
ФДТ применяют для лечения и профилактики рецидивов поверхностного РМП с 80-х годов XX века. Использование ФДТ с этой целью стало возможным благодаря совершенствованию лазерных и эндоскопических технологий и появлению современных малотоксичных фотосенсибилизаторов. Фактически ФДТ представляет собой разновидность химиотерапии, при которой противоопухолевый препарат, в данном случае фотосенсибилизатор, активируется и оказывает свое цитотоксическое действие под влиянием световых лучей. При этом происходят фотохимические реакции и образуется «синглетный кислород». Это химическое соединение вызывает окисление клеточных структур опухоли с последующим их разрушением. Если степень разрушения клеточных структур достигает определенного порога, то клетки гибнут [6, 7]. Первые сеансы внутриполостной ФДТ провели J. Kelly и M. Shell [8, 9], которые показали возможность применения этого метода лечения и связь его результатов с величиной опухолевого очага. Авторы отметили, что при размере опухоли до 1,5 см ее полная деструкция происходит в 66,7-74 % случаев, а при большем размере — только в 33 % случаев.
В настоящее время ФДТ применяют в качестве первичного, противорецидивного, паллиативного лечения, а также в комбинации с традиционными методами лечения. При поверхностных формах опухолей мочевого пузыря ФДТ применяют в качестве основной или адъювантной терапии. Для проведения ФДТ предпочтение отдают фотосенсибилизаторам второго поколения. Последние являются производными хлорина Е6 и обладают мощной полосой поглощения в длинноволновой красной области спектра. К препаратам данной группы относится фотодитазин. Исходным сырьем для производства фотодитазина является микроводоросль Spirulina platensis. Препарат создан на основе производных хлорофилла А и характеризуется свойствами, существенно отличающимися от наиболее известных зарубежных и отечественных аналогов. Фотодитазин хорошо растворяется в воде и не образует агрегированных форм, характерных для производных гематопорфирина. Способность фотодитазина связываться с клеточными мембранами опухолевых клеток обусловливает его высокую фотодинамическую активность. Фотосенсибилизатор более интенсивно накапливается в активно делящихся клетках. Максимум накопления в опухоли наступает через 1,5-2 часа после введения препарата в организм человека. Индекс контрастности по отношению к окружающей нормальной ткани при этом составляет более 10.
Для проведения ФДТ при опухолях мочевого пузыря необходимо следующее оборудование: стандартный цистоскоп с прямым рабочим каналом 6Ch или катетеризационный цистоскоп, фиброоптичес кое волокно, эндоскопическая стойка, источник света. Важными характеристиками лазерных установок являются выходная мощность, время выхода на рабочий режим, гарантированное количество часов работы. В этом отношении не оспоримыми преимуществами обладают диодные лазеры. Они портативны, экономичны, не требуют водяного охлаждения, питаются от обычной электрической сети с напряжением 220 вольт и имеют гарантированный длительный период работы. Для проведения света от лазерной установки к опухоли используют кварцевые моноволоконные световоды длиной от 1,5 до 3 метров и диаметром 6Ch. В зависимости от характера отражения выделяют световоды с прямым и боковым отражением света. В качестве диффузора используют цилиндрический и сферический диффузоры.
Длительность светового воздействия при ФДТ рассчитывается, исходя из заданной, эмпирически подобранной эффективной дозы световой энергии (Е). Для фотодинамической терапии опухолей мочевого пузыря эта величина находится в диапазоне 300-600 Дж/см 2. Выходная мощность на конце световода во время ФДТ составляет 1-2 Вт.
Целью настоящего исследования явилась оценка эффективности применения ФДТ вместе с ТУР при лечении больных с поверхностным РМП.
Пациенты и методы исследования
Под наблюдением в урологической клинике СПбГМУ имени акад. И. П. Павлова находились 36 больных с поверхностным РМП. Среди наблюдаемых больных были 21 мужчина и 15 женщин. Возраст пациентов составил в среднем 60,5 ± 8,5 лет и находился в диапазоне от 42 до 80 лет. Всем больным проводили стандартное урологическое обследование, включавшее в себя сбор анамнеза, физикальное обследование, лабораторные исследования, в том числе цитологический анализ мочи, цистоскопию, УЗИ, КТ или МРТ. Диагноз РМП верифицировали гистологически при исследовании образцов ткани из измененных участков стенки мочевого пузыря. При цистоскопии определяли размеры опухоли, характер роста (экзофитный или стелящийся) и количество опухолевых очагов. При УЗИ КТ или МТР оценивали размер и глубину инвазии опухоли.
Всем больным с поверхностным РМП выполняли трансуретральную резекцию стенки мочевого пузыря в сочетании с ФДТ. Для проведения данных вмешательств использовали резектоскоп Karl Storz, стандартный цистоскоп с прямым рабочим каналом, лазерный аппарат АЛОД-1 «Гранат» с выходной мощностью излучения 0,5-2 Вт и длиной волны 662 нм, интегральный измеритель мощности ИИП-1, световое волокно с прямым отражением света и цилиндрическим световодом и длиной диффузора 1-2 см.
За 1,5 часа до начала трансуретральной резекции внутривенно капельно пациентам в условиях полутемного помещения вводили препарат фотодитазин из расчета 0,5-1,5 мг/кг массы тела. Доза фотосенсибилизатора рассчитывалась для каждого больного индивидуально и зависела не только от его массы тела, но и от размера и характера опухоли мочевого пузыря. В среднем доза фотодитазина составляла 0,8 мг/кг массы тела. Непосредственно перед введением раствор фотодитазина разводили в 0,9 % растворе NaCl в соотношении 1 : 4. Инфузию препарата осуществлял врач или медицинская сестра в его присутствии. Под спинальной анестезией проводилась ТУР опухоли мочевого пузыря до глубокого мышечного слоя, а затем под визуальным контролем проводили локальное облучение зоны резекции и окружающих тканей лазером. Доза световой энергии составляла от 300 до 600 Дж/см 2, а мощность излучения — от 1 до 2 Вт. После завершения вмешательства мочевой пузырь дренировали уретральным катетером. Продолжительность сеанса ФДТ находилась в интервале от 12 до 48 минут и находилась в прямой зависимости от площади облучаемой поверхности, что, в свою очередь, определялось размером опухоли.
Время лазерного воздействия на опухолевую ткань рассчитывали по формуле:
t = Е × S/P;
где t — время экспозиции, с; E — эффективная доза световой энергии, Дж/см 2; S — площадь поверхности опухоли, см 2; Р — мощность на конце световода Вт, с.
Поскольку фотодитазин выводится из организма в течение 28 часов после введения, больные после проведения ФДТ из-за возможной реакции кожи на свет в течение этого времени находились в специально оборудованной затемненной палате.
С целью оценки эффективности комбинированного лечения и выявления рецидивов РМП после операции больным каждые 3 месяца выполняли цистоскопию и цитологическое исследование мочи и каждые 6 месяцев — ультразвуковое исследование мочевого пузыря.
Результаты и обсуждение
Результаты дооперационного обследования позволили оценить особенности клинических проявлений РМП у наблюдаемых нами больных. Один опухолевый очаг был выявлен у 23 (63,9 %) больных, от 2 до 4 опухолевых очагов — у 11 (30,5 %) больных, 5 и более опухолевых очагов — у 2 (5,6 %) пациентов. Опухоль размерами 3 см и менее обнаружена у 24 (66,7 %), а более 3 см — у 12 (33,3 %) больных. У всех обследованных больных диагнос тирован поверхностный РМП. При этом папиллярная опухоль, не прорастающая в собственную пластинку (стадия Та), выявлена у 9 (25 %), а наличие опухолевой инвазии в субэпителиальную основу (стадия Т1) — у 27 (75 %) пациентов. Степень дифференцировки опухоли была высокой (G-1) у 23 (63,9 %) больных, умеренной (G-2) — у 10 (27,8 %) больных, низкой (G-3) — у 5 (8,3 %) больных. Чаще всего у наблюдаемых нами пациентов мы выявляли высокодифференцированные одиночные опухоли стадии Т1 и размером до 3 см.
В раннем послеоперационном периоде после удаления уретрального катетера у всех больных отмечено учащенное, болезненное мочеиспускание в течение 1-3 суток. Макрогематурия зафиксирована у 3 больных (8,3 %) в первые сутки после операции. В дальнейшем ни у одного из пациентов макрогематурию не наблюдали. Проявлений системной токсичности фотодитазина в виде гиперемии или фотодерматита также отмечено не было.
Все пациенты находились под наблюдением по крайней мере 12 месяцев после операции, поэтому этот срок взят для анализа частоты рецидивирования РМП. Наибольший срок наблюдения на сегодняшний день составляет 18 месяцев после комбинированного лечения.
Рецидивы РМП отмечены у 4 (11,1 %) из 36 находившихся под наблюдением больных. Рецидивы РМП были выявлены при контрольных обследованиях на сроках 9 и 12 месяцев после операции. Отмечено, что рецидивирование опухолевого процесса после комбинированного лечения РМП происходило у больных с изначально множественными очагами опухоли, умеренной или низкой дифференцировкой опухолевой ткани и при опухолях большого объема. В настоящем исследовании мы не смогли выявить связь между временем экспозиции и дозой фотосенсибилизатора, с одной стороны, и вероятностью рецидива опухоли мочевого пузыря с другой. Это связано, по-видимому, с недостаточно большим количеством наблюдаемых пациентов.
Заключение
Результаты проведенного исследования показали целесообразность применения ФДТ вместе с трансуретральной резекцией при комбинированном лечении поверхностного РМП. В течение 1-го года после операции у 88,9 % пациентов не выявлено рецидивирования опухолевого процесса. Продолжение исследований в данном направлении представляется весьма перспективным.
Список литературы
1. Мартов А. Г., Сысоев П. А., Гущин Б. Я. Сравнительные резуль таты ТУР и электровапоризации при поверхностном раке мо чевого пузыря / Материалы 4й Всероссийской науч.практич. конф. 2001. С. 68-69.
2. Русаков И. Г., Быстров A. A. Хирургическое лечение, химио и иммунотерапия больных поверхностным раком мочевого пузыря // Практическая онкология. 2003. № 4. С. 214-224.
3. Чиссов В. И., Старинский В. В., Петрова Г. В. Состояние он кологической помощи населению России в 2009. М., 2010. 196 c.
4. Botteman M. F., Pashos C. L., Hauser R. S. et al. Quality of life as pects of bladder cancer: a review of the literature // Qual Life Res. 2003. Vol. 12, N 6. P. 675-688.
5. Dalbagni G. The management of superficial bladder cancer // Nat. Clin. Pract. Urol. 2007. Vol. 4, N 5. P. 254-260.
6. Dougherty T. J. Gomer C., Henderson B. et al. Photodynamic therapy [Review] // J. Natl. Cancer Inst. 1998. Vol. 90, N 12. P. 889-905.
7. Henderson B. W., Dougherty T. J. How does photodynam ic therapy work? // Photochem. Photobiol. 1992. N 55. P. 145-157.
8. Kelly J. F., Snell M. E., Berenbaum M. C. Photodynamic de struction of human bladder carcinoma // Br. J. Cancer. 1975. N 31. P. 237.
9. Kelly J. F., Snell M.E. Hematoporphyrin derivative: A possible aid in the diagnosis and therapy of carcinoma of the bladder // J. Urol. 1976. Vol. 115. P. 150-151.
10. Lindemann-Docter K., Knuchel-Clarke R. Histopathology of uro thelial carcinomas: crucial for patient management // Urologe A. 2008. Vol. 47, N 5. P. 627-638.
11. Parekh D. J., Bochner B. H., Dalbagni G. Superficial and mus cleinvasive bladder cancer: principles of management for outcomes assessments // J. Clin. Oncol. 2006. Vol. 24, N 35. P. 5519-5527.
Experience of application of photodynamic therapy in the combined treatment of superficial bladder cancer
Slesarevskaya M. N., Sokolov A. V.
Summary. The aim of the study was to evaluate the efficacy of photodynamic therapy and transurethral resection in the combined treatment of 36 patients with superficial bladder cancer. As a photosensitizer was used Photoditazine in average dose of 0.8 mg/kg body weight. Exposure was from 12 to 48 minutes. Tumor recurrence in the first 12 months after treatment was observed in 4 (11.1%) patients, which is regarded by us as a perfectly acceptable.
Key words: superficial bladder cancer; photodynamic therapy; Photoditazine.
Источник