Как выходит моча при удалении мочевого пузыря
Содержание статьи
Рак мочевого пузыря
Злокачественная опухоль или рак мочевого пузыря — это опасное, а зачастую и смертельное новообразование, изначально исходящее из слизистой мочевого пузыря, способное поразить как располагающиеся рядом с мочевым пузырем органы (предстательную железу, мочеиспускательный канал, матку, прямую кишку), так и отдаленные (легкие, печень, кости, головной мозг).
Злокачественные опухоли мочевого пузыря, классификация, стадии
В зависимости от вида клеток, из которых происходит опухоль, выделяют разные типы рака мочевого пузыря. Наиболее распространена уротелиальная, или переходно-клеточная, карцинома. Она встречается в 90–95% случаев. Гораздо реже опухоль представляет собой аденокарциному, плоскоклеточный рак, мелкоклеточную карциному, саркому (злокачественную опухоль из соединительной ткани).
Стадии рака мочевого пузыря:
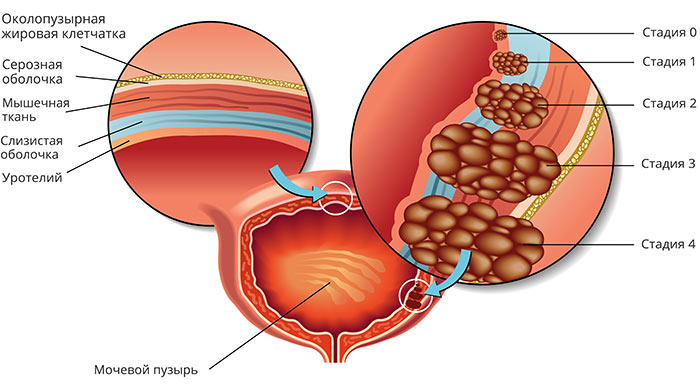
- I — опухоль находится в пределах уротелия (слизистой оболочки) и не прорастает глубже.
- II -опухоль проросла глубже в стенку мочевого пузыря, но все еще не прорастает за его пределы.
- III — опухоль проросла за пределы мочевого пузыря и распространилась на окружающие ткани.
- IV — рак мочевого пузыря с метастазами.
Причины рака мочевого пузыря, факторы риска
Известно, что существуют факторы, которые повышают риск онкологии мочевого пузыря. На некоторые из них можно повлиять, на другие (такие как наследственность и возраст) нельзя:
- Самый значимый фактор риска — курение. У курильщиков заболевание возникает в три раза чаще, чем у некурящих людей. Считается, что примерно половина случаев рака мочевого пузыря у мужчин и женщин связана с курением. Табачный дым содержит токсичные вещества, которые попадают в кровь и выделяются вместе с мочой. Они задерживаются в мочевом пузыре и вызывают злокачественное перерождение клеток слизистой оболочки.
- Некоторые профессии предполагают контакт с вредными веществами, которые повышают вероятность возникновения злокачественных опухолей мочевого пузыря. В группе повышенного риска работники предприятий, которые занимаются производством красителей (воздействие бензидина и бета-нафтиламина), резиновой, кожевенной, текстильной, лакокрасочной продукции, художники, машинисты, парикмахеры (воздействие веществ, которые входят в состав красок для волос), водители грузовиков (воздействие продуктов сгорания дизельного топлива).
- Было замечено, что раком мочевого пузыря реже страдают люди, которые пьют много жидкости. Вероятно, причина в том, что мочевой пузырь у них регулярно очищается.
- Чаще всего заболевание диагностируют в старшем возрасте. Более 90% пациентов с раком мочевого пузыря — люди старше 55 лет.
- У мужчин риски выше, чем у женщин.
Как избежать рака мочевого пузыря? На что обратить внимание?
- Извечный совет всех врачей — не курите. Не курите вообще.
- Частный совет онкоуролога: убедитесь, что вы не используете бензидиновых красителей в творчестве.
- Не задерживайте мочу, лучше посетить туалет каждые 2-3 часа, чем мочиться раз в день.
- И если вдруг в моче показалась кровь, даже капелька, то срочно, в этот же день — к урологу.
Особенно опасно появление крови в моче без боли, жжения и учащения мочеиспускания. Чаще всего это означает, что кровотечение происходит из опухоли мочевого пузыря. Также важным является ежегодная диспансеризация у уролога: УЗИ почек и мочевого пузыря, особенно для тех, у кого родственники болели раком мочевого пузыря.
Что делать, если у близкого человека выявили опухоль мочевого пузыря?
На приём к онкоурологу. Максимально возможно – быстро. Онкоуролог выполнит ряд диагностических процедур и предложит тот или иной вариант лечения. Важно понимать, что способы лечения рака мочевого пузыря разных стадий имеют кардинальные отличия. И чем раньше опухоль выявлена, тем больше шансов, что лечение будет радикальным. Не относитесь равнодушно к появлению даже слабого красного окрашивания в моче, это может иметь самые печальные последствия.
Симптомы злокачественных опухолей мочевого пузыря
Чаще всего признаки злокачественных опухолей мочевого пузыря неспецифичны, в большинстве случаев они бывают вызваны другими заболеваниями. Установить точный диагноз можно только после обследования.

Обычно первый признак рака мочевого пузыря — примеси крови в моче. Они могут окрашивать мочу в оранжевый, розовый, темно-красный цвет. Кровь может появиться один раз, а потом моча несколько недель или месяцев снова выглядит нормально.
Другие возможные симптомы:
- Частые мочеиспускания.
- Боли, рези во время мочеиспусканий.
- Затруднение во время мочеиспускания, слабая струя мочи.
При запущенном злокачественном образовании мочевого пузыря возникают такие симптомы, как боли в пояснице, невозможность помочиться, постоянная слабость и усталость, снижение аппетита и потеря веса, боли в костях, отеки на ногах.
Многие из симптомов, перечисленных выше, возникают при аденоме простаты у мужчин, мочекаменной болезни, отеке слизистой оболочки мочевого пузыря при цистите и других заболеваниях.
Особенности и симптомы рака мочевого пузыря у женщин
Несмотря на различия в строении женской и мужской мочеполовой системы, признаки рака мочевого пузыря у женщин и мужчин не различаются. Есть только один небольшой нюанс: женщины чаще игнорируют кровь в моче, особенно если она появилась незадолго до месячных или во время них. Из-за этого они позже обращаются к врачу.
Некоторые факты:
- Женщины страдают злокачественными опухолями мочевого пузыря реже, чем мужчины.
- Шансы среднестатистической представительницы прекрасного пола заболеть этим онкозаболеванием — 1:88.
- У женщин заболевание обычно диагностируют в более позднем возрасте, чем у мужчин.
- Обычно у женщин обнаруживают менее агрессивные и менее инвазивные опухоли.
- Но если обнаружен запущенный инвазивный рак, шансы выжить у женщины ниже, чем у мужчины.
Особенности рака мочевого пузыря у мужчин
- Мужской пол — фактор риска рака мочевого пузыря. У мужчин заболевание встречается чаще, чем у женщин.
- Шансы мужчины заболеть данной онкопатологией в течение жизни — 1:26.
- У мужчин рак мочевого пузыря обычно диагностируют в более раннем возрасте, чем у женщин, опухоль обычно оказывается более агрессивной и инвазивной.
- У мужчин опухоль может имитировать симптомы аденомы простаты.
Что важно в диагностике рака мочевого пузыря?
Методы диагностики:
- ТУР-биопсия,
- цистоскопия.
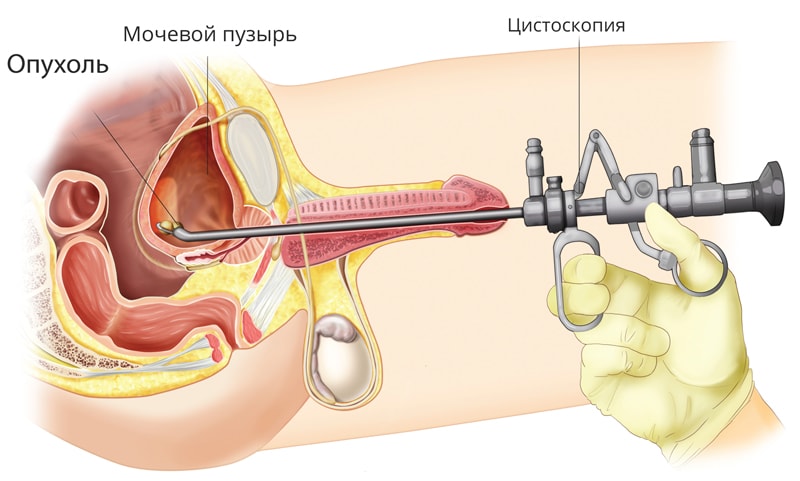
Первое и совершенно необходимое исследование — это цистоскопия. Многие знают про гастроскопию — процедуру осмотра желудка. Практически так же можно определить и цистоскопию — осмотр внутренней поверхности мочевого пузыря.
В Европейской онкологической клинике используются современные цистоскопы Karl Storz и Olympus, процедура выполняется с обезболиванием.
Еще один важный способ диагностики рака мочевого пузыря — ТУР-биопсия. Через мочеиспускательный канал без внешних разрезов вводится специальный инструмент — резектоскоп. Опухоль удаляется в пределах здоровых тканей и отправляется на гистологическое исследование и цитологию мочевого пузыря. И здесь применение фотодинамической диагностики позволяет расширить возможности стадирования: ведь ТУР – это не только диагностика, но в ряде случаев и способ лечения опухоли мочевого пузыря. В синем цвете хирургу видны самые мелкие участки слизистой, пораженных опухолью, для возможности их полного удаления.
Безусловно, важны такие исследования, как компьютерная томография, рентгенография грудной клетки, УЗИ органов брюшной полости. КТ позволяет оценить наличие и размер метастазов, находить пораженные лимфатические узлы, понять, успела ли опухоль выйти за пределы мочевого пузыря и поразить прямую кишку, матку, предстательную железу. Рентгенография грудной клетки делает возможным исключение метастазов в легкие, а УЗИ – в печень.
Методы лечения рака мочевого пузыря
Способ лечения зависит от стадии рака мочевого пузыря. На первых стадиях возможно сохранение мочевого пузыря, хирургическим способом удаляется только сама опухоль. Как было сказано выше, для этого используется ТУР – трансуретральная резекция – операция без каких-либо разрезов, через мочеиспускательный канал. Резко уменьшает количество рецидивов использование фотодинамической диагностики во время ТУР, ведь врач легко видит все пораженные участки мочевого пузыря. После удаления опухоли мочевого пузыря используется внутрипузырная химиотерапия или иммунотерапия: в мочевой пузырь курсами вливается либо химиопрепарат, активный против опухоли, либо вакцина БЦЖ. Введение противотуберкулезной вакцины БЦЖ при раке мочевого пузыря используется в медицине давно и увеличивает безрецидивную выживаемость больных.
Особым случаем является наличие опухоли мочевого пузыря, которая «сидит» прямо на устье мочеточника. Такая опухоль может блокировать отток мочи из почки. Для восстановления функции почки выполняется пункционная нефростомия – установка специальной трубочки в почку для восстановления оттока мочи.
К сожалению, удаление опухоли устья мочеточника сопряжено с обязательным повреждением этого органа. В Европейской онкологической клинике мы предлагаем удаление подобной опухоли при помощи трансуретральной резекции с сохранением мочеточника. Для этого мы пересаживаем мочеточник в верхнюю часть мочевого пузыря лапароскопическим способом, что позволяет избавить пациента от нефростомы.
Если же мы видим, что опухолей много, что имеются метастазы в местные лимфатические узлы, что опухоль слишком глубоко поражает стенку мочевого пузыря, то здесь необходимо решать вопрос об удалении мочевого пузыря и проведении облучения либо системной химиотерапии.
Необходимо понимать, что удаление мочевого пузыря – цистэктомия – это одна из наиболее сложных операций в урологии. Для обеспечения безопасности пациентов, кому показана цистэктомия, в Европейской онкологической клинике создан хирургический блок, отвечающий стандартам безопасности Израиля. Это мощная анестезиологическая и реанимационная служба, операционный зал, оснащенный самым современным оборудованием, позволяющим минимизировать кровопотерю. В блоке интенсивной терапии происходит круглосуточное врачебное наблюдение послеоперационных больных, постоянно мониторируются функции жизненно важных органов.
Как жить без мочевого пузыря, если онкоуролог рекомендует его удаление?
Самый неприятный вариант – удалили мочевой пузырь, а мочеточники вывели на кожу. У пациента нет резервуара для накопления мочи, она выходит в пластиковые мочеприемники, прикрепленные к телу. Качество жизни этих людей оставляет желать лучшего: это постоянный запах мочи, затруднения в гигиенических процедурах, резко повышенный риск инфекции почек, часто – невозможность просто выйти на улицу. Между тем, существует несколько способов создания нового мочевого пузыря, так называемая неоцистопластика. Изолируется участок кишечника, туда пересаживаются мочеточники, создается анастомоз (соединение) с мочеиспускательным каналом. Это позволяет пациенту мочиться как обычно.

Важно знать и понимать, что в лечении рака мочевого пузыря важна не только операция. Комплексный подход, совместные усилия хирурга-онкоуролога, химиотерапевта, радиолога зачастую помогают не только спасти жизнь пациенту, но и сохранить качество его жизни. В Европейской онкологической клинике по поводу каждого пациента с раком мочевого пузыря обязательно проводится консилиум этих специалистов, что позволяет достигнуть хороших результатов. В сложных неоднозначных случаях мы стараемся получить «второе мнение» наших коллег из ведущих университетских клиник Австрии, Германии и Израиля.
Почему при обнаружении маленькой опухоли врач-онкоуролог рекомендует выполнение расширенного обследования костей, печени, легких?
В онкологии нет понятия «маленькая опухоль». Есть понятие «стадия». В довольно большом количестве случаев первичная опухоль не превышает полсантиметра, однако она уже успела «забросать метастазами» отдаленные органы. Если просто удалить опухоль, даже удалить радикально, вместе с мочевым пузырем, то человека убьет метастаз, который вовремя не был выявлен.
Иммунотерапия при раке мочевого пузыря
Иммунотерапия — современное, активно развивающееся направление в лечении онкологических заболеваний, на которое многие врачи и ученые возлагают большие надежды. Применяется она и при злокачественных опухолях мочевого пузыря.
Внутрипузырное введение вакцины БЦЖ практикуется уже более 30 лет. В мочевой пузырь, зачастую после трансуретральной резекции опухоли на ранней стадии, вводят ослабленные туберкулезные палочки. Они не могут вызвать туберкулез, но активируют клетки иммунной системы, которые начинают «замечать» и атаковать опухоль.
Более современное направление в иммунотерапии злокачественных опухолей мочевого пузыря — применение ингибиторов контрольных точек. Контрольные точки — это молекулы, которые использует иммунная система, чтобы не допустить атаки на здоровые ткани. Эти молекулы иногда используют опухолевые клетки, чтобы подавить иммунный ответ. Ингибиторы контрольных точек помогают снять этот блок:
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенсио), дурвалумаб (Имфинзи).
- Блокаторы PD-1: ниволумаб (Опдиво), пембролизумаб (Кейтруда).
Цены в Европейской онкологической клинике на лечение рака мочевого пузыря
- Консультация онколога — 5100 руб.
- Консультация химиотерапевта — 6900 руб.
- Проведение внутрибрюшной химиотерапии (инфузия, без стоимости лекарственных препаратов) — 19100 руб.
- Резекция мочевого пузыря — 61000 руб.
- Резекция мочевого пузыря с резекцией мочеточника — 93800 руб.
- Трансуретральная резекция (ТУР) мочевого пузыря — 120000 руб.
- Расширяющая кишечная пластика мочевого пузыря — 85300 руб.
- Проведение химиотерапии (инфузия, без стоимости лекарственных препаратов) — 15000 руб.
- Проведение иммунотерапии (без стоимости лекарственных препаратов) — 15000 руб.
- Анти PD-1 терапия — 334000 руб.
Источник
Профилактика острой задержки мочеиспускания в раннем послеоперационном периоде у хирургических больных.
Современные научные достижения хирургии, травматологии и анестезиологии позволяют значительно расширить объем оперативных вмешательств у лиц пожилого и старческого возраста. Однако сама операционная травма, кровопотеря, анестезиологическое пособие и особенности послеоперационного периода, в первую очередь связанные с длительной иммобилизацией после таких операций, чреваты возникновением ряда осложнений, одним из которых является острая задержка мочеиспускания (ОЗМ). Послеоперационную острую задержку мочеиспускания (ПЗМ) можно охарактеризовать как внезапно возникшую невозможность самостоятельного мочеиспускания при наличии позывов к нему и наполненном мочевом пузыре в течение 6–10 ч после операции [16].
Данное осложнение встречается, по данным ряда авторов, от 2 до 60% после хирургических вмешательств [13–15, 17, 18, 20]. На развитие ОЗМ оказывают влияние многие факторы, препятствующие нормальному оттоку мочи, такие как: механическая обструкция (стриктура уретры, доброкачественная гиперплазия предстательной железы — ДГПЖ); динамическая обструкция (вследствие повышенного мышечного тонуса), нарушение иннервации стенки мочевого пузыря (возможно и как результат лекарственной терапии) и др. [12]. Нередко ОЗМ возникает после оперативных вмешательств, причем не только у больных, страдающих ДГПЖ. Механизм ПЗМ связывают со снижением внутрипузырного давления на 20–40% в горизонтальном положении; с выключением из акта мочеиспускания мышц передней брюшной стенки; с рефлекторным воздействием перенесенной операции на сократительную способность мочевого пузыря; с отрицательным влиянием общей, эпидуральной, спинно-мозговой анестезии и лекарственных препаратов (миорелаксантов, наркотических анальгетиков). Особенно часто ОЗМ наблюдается после проктологических операций. Причинами этого являются денервация мочевого пузыря во время мобилизации прямой кишки, нарушение нормального анатомического расположения мочевого пузыря с его смещением кзади, кровоизлияния в стенку мочевого пузыря. В. И. Кныш и соавторы провели исследование частоты и причин развития атонии мочевого пузыря после радикальных операций по поводу рака прямой кишки. По мнению авторов, причиной атонии мочевого пузыря после подобных операций служит его прогрессирующая дисфункция в результате нарушения парасимпатической иннервации и развития посттравматического перицистита. Частота возникновения послеоперационной ОЗМ у подобных пациентов зависит от объема оперативного вмешательства и является достоверно более высокой после наиболее травматичной операции — брюшно-промежностной экстирпации прямой кишки [7].
По данным W. E. Varger [19], после операций по поводу рака прямой кишки ишурия возникает в 13–32% наблюдений. З. С. Вайнберг [3, 11] наблюдал ОЗМ у 44,5% больных после операций по поводу геморроя, полипов и трещин прямой кишки.
Больные с повреждениями опорно-двигательного аппарата занимают одно из ведущих мест по численности среди поступивших в стационар в экстренном порядке. Длительная иммобилизация у таких больных ведет к венозному застою в органах малого таза и отеку предстательной железы. С учетом того, что оперативные вмешательства на нижних конечностях производятся преимущественно под эпидуральной или спинальной анестезией, риск развития ОЗМ в раннем послеоперационном периоде крайне высок, что обусловлено блокадой афферентных и эфферентных парасимпатических сигналов, проходящих по корешкам спинного мозга и приводящих к динамической обструкции нижних мочевых путей. Также возникают нарушения в сердечно-сосудистой и дыхательной системах, выражающиеся в повышении артериального давления, нарушениях ритма сердца, ограничении экскурсий диафрагмы и снижении глубины дыхания. Переполнение мочевого пузыря способствует нарушению функции поджелудочной железы и печени, развитию пареза кишечника [4].
Основным лечебным мероприятием, применяющимся для разрешения ПЗМ, считается катетеризация мочевого пузыря — быстрый и эффективный способ эвакуации мочи из мочевого пузыря. Интермиттирующая катетеризация позволяет ликвидировать ПЗМ без выполнения оперативного вмешательства у 23% больных с ДГПЖ. Эффективность катетеризации ниже у больных старше 75 лет, при емкости мочевого пузыря свыше 1000 мл и при внутрипузырном давлении менее 35 см вод. ст. [12].
Однако даже однократная катетеризация мочевого пузыря, а тем более длительное дренирование катетером приводит к инфицированию мочевыводящих путей, проявляющемуся от ассимптоматической бактериурии до уросепсиса с высокой степенью летальности [5]. При ишурии нарушается опорожнение не только нижних, но и верхних мочевыводящих путей, что грозит развитием острого гнойно-воспалительного процесса. Часто ишурии сопутствует пузырно-мочеточниковый рефлюкс (17%), и это повышает опасность возникновения острого пиелонефрита. Снижаются почечный кровоток, клубочковая фильтрация и диурез [10]. В результате у пациентов с острой задержкой мочеиспускания может возникнуть почечная недостаточность [1, 2, 6, 8].
Одним из основных подходов в профилактике послеоперационной задержки мочеиспускания у данной категории пациентов является назначение α-адреноблокаторов, которые блокируют действие катехоламинов на α1-адренорецепторы нижних отделов мочевыводящих путей, приводят к расслаблению гладких мышц шейки мочевого пузыря, простатического отдела уретры, стромальной части простаты, тем самым улучшая максимальную скорость потока мочи и уменьшая остаточный объем мочи. Кроме того, α1-адреноблокаторы воздействуют и на детрузор, улучшая кровоток в его стенке и снижая явления гипоксии [9].
Профилактический прием α1-адреноблокаторов в пред- и послеоперационный период приводит к снижению частоты развития ПЗМ, ускорению восстановления адекватного мочеиспускания и предупреждению инфекционно-воспалительных осложнений со стороны мочеполовой системы. Кроме того, под воздействием боли и стресса, которые пациент испытывает при операции, повышается стимуляция симпатического отдела вегетативной нервной системы, что приводит к инфравезикальной обструкции. Последней способствует подавление рефлекса мочеиспускания после спинномозговой анестезии. Антагонисты α1-адренорецепторов могут предотвратить развитие инфравезикальной обструкции, связанной с повышением активности симпатической нервной системы, и, таким образом, уменьшить риск развития острой задержки мочеиспускания. Препарат теразозин (Сетегис) является производным хиназолина, селективным и конкурентным антагонистом α1-адренорецепторов, отвечающих за сокращение гладкой мускулатуры предстательной железы, ее капсулы, проксимального отдела уретры и основания мочевого пузыря. Данный эффект приводит к уменьшению симптомов инфравезикальной обструкции. Кроме того, отличительной особенностью теразозина является его гипотензивный эффект в дозе 5 мг, вследствие снижения периферического сопротивления за счет блокады α1-адренорецепторов.
В урологической клинике РУДН на базе ГКБ № 29 г. Москвы в течение 2004–2006 гг. проведено исследование по оценке эффективности применения α1-адреноблокатора теразозина (Сетегиса) в дозировке 5 мг в качестве средства профилактики нарушений мочеиспускания в раннем послеоперационном периоде у больных с повреждениями опорно-двигательного аппарата и у больных с патологией прямой и толстой кишки и сопутствующей ДГПЖ.
Открытое сравнительное исследование проведено на 86 пациентах, поступивших в травматологическое отделение больницы по поводу травм опорно-двигательного аппарата и 66 пациентах колопроктологического отделения с соответствующей патологией и сопутствующей ДГПЖ, которым планировалось оперативное лечение. Из группы исследования исключены пациенты, которым производились операции на мочевом пузыре, простате, уретре, принимавшие α1-адреноблокаторы в анамнезе, а также пациенты с инфекцией мочевыводящих путей.
По возрасту распределение пациентов было следующим: в основной группе количество пациентов от 50 до 59 лет составило 22 человека (27%), от 60 до 69 лет — 36 (44%), от 70 до 79 лет — 24 человека (29%). В контрольной группе распределение по возрасту было следующим — от 50 до 59 лет — 24 больных (34%), от 60 до 69 лет — 27 человек (39%) и от 70 до 79 лет 19 (27%) человек.
Диагноз ДГПЖ устанавливался на основании жалоб, пальцевого ректального исследования, шкалы IPSS, УЗИ почек и мочевого пузыря с определением количества остаточной мочи, ТРУЗИ с определением объема предстательной железы и данных урофлоуметрии. По результатам ТРУЗИ распределение пациентов по объему предстательной железы в основной и контрольной группах было следующим (табл. 1).
У 61 пациента основной (74 %) и 51 пациента (73%) контрольной группы имела место гипертоническая болезнь с уровнем артериального давления от 140/90 до 180/100 мм рт. ст., получавших до поступления в стационар гипотензивную терапию.
Оперативному лечению, проводившемуся под спинальной или эпидуральной анестезией, были подвергнуты все 152 пациента.
Пациенты с травматологической патологией были распределены следующим образом. Основную группу составили 47 пациентов, из которых 22 (47 %) имели перелом шейки бедра (из них у 15 (32%) произведен остеосинтез шейки бедренной кости, у 7 (15%) — эндопротезирование шейки бедренной кости), у 14 (30%) — перелом костей голени с последующим проведением остеосинтеза костей голени, у 11 (23%) — перелом бедра (с проведением остеосинтеза бедренной кости). Всем пациентам проводилось скелетное вытяжение или иммобилизация в предоперационном периоде. Все пациенты этой группы в течение 5 сут перед и 10 сут после операции принимали препарат теразозин (Сетегис) в дозе 5 мг однократно на ночь.
Контрольную группу составили 39 пациентов: у 13 (33%) произведен остеосинтез шейки бедренной кости, у 6 (15%) — эндопротезирование шейки бедренной кости, у 11 (28%) — остеосинтез лодыжки, у 9 (24%) — остеосинтез бедренной кости.
Результаты обследования пациентов показали, что в группе больных, получавших в течение 5 сут перед операцией и 10 сут после операции препарат Сетегис в дозе 5 мг не отмечалось нарушений акта мочеиспускания в раннем послеоперационном периоде. У одного пациента, страдающего ДГПЖ, развилась задержка мочеиспускания, которая разрешилась однократной катетеризацией мочевого пузыря. В то же время из 39 пациентов контрольной группы, не получавших препарат Сетегис в пред- и послеоперационном периодах, у 6 (15%) пациентов ранний послеоперационный период осложнился ОЗМ, что потребовало дренирования мочевого пузыря уретральным катетером в течение 5 сут на фоне приема Сетегиса и антибактериальной терапии, после чего у них восстановилось самостоятельное мочеиспускание. Двум пациентам (5%) произведена троакарная цистостомия в связи с отсутствием самостоятельного мочеиспускания после удаления катетера. Результаты исследования показали, что при контрольном измерении объема остаточной мочи у больных основной группы отмечалось его достоверное снижение после окончания приема Сетегиса, по сравнению с контрольной (табл. 2).
Результаты оценки состояния больного с ДГПЖ по международной шкале симптомов (IPSS) до начала исследования показали, что средний балл у обследуемых пациентов составил 22,1. Через 2 нед приема препарата теразозин (Сетегис) у пациентов основной группы он снизился до 16,3, тогда как в контрольной группе составлял 21,6.
Пациенты с колопроктологической патологией были распределены следующим образом. Основную группу составили 35 пациентов, контрольную группу — 31 пациент (табл. 3). Возраст пациентов в среднем составил 65 лет.
Результаты обследования 79 пациентов с колопроктологическими заболеваниями и сопутствующей ДГПЖ представлены в табл. 4.
Оперативному лечению были подвергнуты все 66 пациентов. 21 пациенту (32%) была произведена геморроидэктомия, 16 (24%) — иссечение трещины и дозированная задняя сфинктеротомия, 4 (6%) — брюшно-промежностная экстирпация прямой кишки с сигмостомией, 6 (9%) — брюшно-анальная резекция прямой кишки, 5 (8%) — электрорезекция опухоли прямой кишки, 8 (12%) — передняя резекция сигмовидной кишки, 6 (9%) — резекция сигмы и анастомоз. Операции по поводу геморроя и анальных трещин осуществлялись под внутривенной анестезией, операции на прямой и сигмовидной кишке — под комбинированным обезболиванием — эпидуральной и внутривенной анестезией.
Результаты обследования пациентов показали, что в группе, получавших в течение 5 сут перед операцией и 10 сут после операции Сетегис в дозе 5 мг, не отмечалось нарушений акта мочеиспускания в раннем послеоперационном периоде. В то же время из 31 пациента контрольной группы, не получавших препарат в пред- и послеоперационном периодах и перенесших операции на прямой и сигмовидной кишке, у 4 (13%) в раннем послеоперационном периоде отмечалась острая задержка мочеиспускания, которая потребовала катетеризации мочевого пузыря в течение 4 сут. При этом 1 пациенту, в связи с невосстановившимся самостоятельным мочеиспусканием, была произведена троакарная цистостомия.
Назначение препарата Сетегис привело к снижению суммарной оценки IPSS на 29% к уменьшению количества остаточной мочи на 41% и к увеличению максимальной скорости потока мочи на 57%.
При анализе динамики артериального давления у всех исследуемых пациентов нами отмечено, что у пациентов основной группы страдающих гипертонией, на фоне приема препарата Сетегис в дозе 5 мг отмечалось минимальное, статистически значимое снижение систалического/диастолического давления, в среднем на 5,4/3,3 мм рт. рт., тогда как у пациентов контрольной группы, страдающих гипертонией, достоверного снижения артериального давления отмечено не было. Частота сердечных сокращений не менялась в обеих группах.
Заключение
Назначение препарата Сетегис 5 мг пациентам с повреждениями опорно-двигательного аппарата и патологией прямой и толстой кишки в течение 5 сут перед и 10 сут после операции в дозировке 5 мг однократно является не только эффективным и обоснованным, так как на фоне приема препарата достоверно уменьшаются динамические и ирритативные симпотомы заболевания предстательной железы, но и экономически целесообразным.
Профилактический прием α1-адреноблокаторов в пред- и послеоперационном периоде больными с повреждениями опорно-двигательного аппарата и патологией прямой и толстой кишки предотвращает развитие нарушений мочеиспускания вплоть до развития острой задержки мочеиспускания в раннем послеоперационном периоде, в связи с чем не требуется катетеризация мочевого пузыря и, как следствие, предотвращается инфицирование мочевых путей, а следовательно, сокращаются сроки пребывания в стационаре.
Кроме того, препарат теразозин (Сетегис) является препаратом выбора среди α1-адреноблокаторов при лечении больных ДГПЖ с сопутствующей гипертонической болезнью, так как обладает небольшим гипотензивным эффектом у этой категории пациентов.
Учитывая полученные нами результаты при обследовании пациентов с повреждениями опорно-двигательного аппарата и паталогиями прямой и толстой кишки в пред- и послеоперационном периоде, можно предположить, что аналогичный эффект будет получен у больных, страдающих ДГПЖ, в пред- и послеоперационном периоде с другой хирургической паталогией.
По вопросам литературы обращайтесь в редакцию.
В. П. Авдошин, доктор медицинских наук, профессор
М. И. Андрюхин, кандидат медицинских наук, доцент
С. А. Пульбере
РУДН, Москва
Источник