Эмболизация сосудов опухоли мочевого пузыря
Содержание статьи
Эмболизация
Эмболизация — малоинвазивная процедура, которая может дополнять хирургическое лечение или использоваться самостоятельно. Хирург через прокол в бедренной артерии проводит специальный катетер в артерии, непосредственно питающие опухоль и через него закрывает их специальными частицами — эмболами, которые перекрывают кровоток. В ряде случаев используют эмболы, способные выделять химиопрепарат в ткань опухоли — такое вмешательство называется химиоэмболизация.
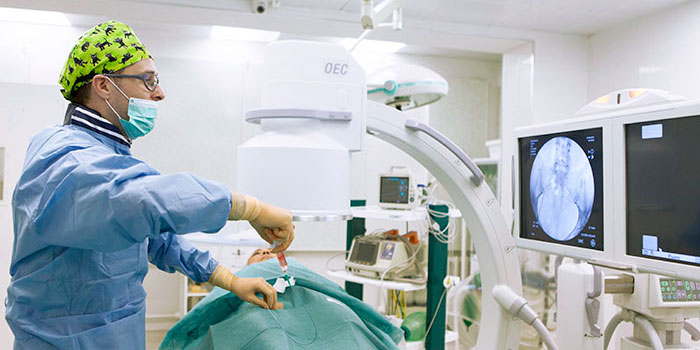
Эмболизация применяется для лечения многих заболеваний. С начала XXI века эта процедура получает все более широкое применение и в онкологии, в первую очередь из-за своей эффективности и малоинвазивности — эмболизации безболезненны, не требуют наркоза, инструмент вводится через пункцию артерии, т. е. нет никакой операционной раны.
Эмболизация у онкологических пациентов
Эмболизация артерий для лечения опухолей и их метастазов помогает решить следующие задачи:
- в качестве самостоятельного метода лечения — эмболизация (чаще всего в варианте химиоэмболизации) может приводить к ишемии ткани опухоли и ее гибели. Для некоторых заболеваний, например, ряд опухолей печени, этот лечения может приводить к полной ремиссии без хирургического лечения.
- в сочетании с хирургическим лечением эмболизация используется как вспомогательная технология — чаще всего для уменьшения кровотечения во время операции за счет деваскуляризации (обескровливания) новообразования;
- в ряде случаев эмболизация, выполненная перед операцией, дает возможность проведения более радикальной операции за счет предварительного уменьшения опухоли;
- эмболизация также может применяться для борьбы с симптомами и осложнениями онкологических заболеваний — это в первую очередь остановка опасных кровотечений, которые угрожают жизни пациента, кроме того — облегчение боли, вызванной злокачественным новообразованием; еще одним эффектом является уменьшение объема и замедление роста опухоли.
Виды эмболизации артерий у онкологических больных:
- предоперационная — выполняется в качестве первого этапа хирургического вмешательства;
- в качестве самостоятельного метода лечения — чаще всего при опухолях печени, почек и ряде других опухолей
- в качестве паллиативного метода лечения — для остановки кровотечений, уменьшения болевого синдрома, уменьшения объемов и темпа роста опухоли.
Как проводится эмболизация артерий?
Эмболизация выполняется врачами-рентгенохирургами в специально оборудованной ангиографической операционной. Перед эмболизацией всегда проводят ангиографию. В сосуды вводят рентгенконтрастное вещество, в ходе чего записывают рентгеновское изображение в цифровом видеоформате. Это помогает врачу оценить расположение и анатомию сосудов, определить, из каких артерий осуществляется кровоснабжение опухоли.
Чаще всего эмболизацию выполняют под местной анестезией. В редких случаях приходится использовать общую анестезию (наркоз). За 4-5 часов до процедуры пациента просят ограничить прием пищи, иногда дают успокоительные препараты.
В большинстве случаев доступ к нужному сосуду получают через бедренную артерию, это самый типичный доступ для всех ангиографических исследований и вмешательств, но могут использовать и другие артерии в других местах (лучевую на запястье, плечевую в области локтевого сгиба и т. п.). Врач обрабатывает кожу антисептиком и делает небольшой прокол, вводит в артерию специальный катетер размером не более 1,5 мм и продвигает его до тех пор, пока не достигнет нужного сосуда. Через катетер в сосуд вводят эмболы, которые перекрывают его просвет.
Существуют разные виды эмболов:
- Поливинилалкоголь (PVA) представляет собой частицы размером от 50 до 1000 мкм. Это относительно недорогой и простой в применении препарат, однако, в настоящее время он считается устаревшим. Сейчас чаще всего применяют сферические эмболы, например, Bead Block и Embozene.
- Спирали из платины и нержавеющей стали. После установки в просвете сосуда на них быстро образуется тромб, который перекрывает кровоток. Иногда такие спирали применяют вместе с желатиновыми губками: сначала устанавливают спираль, а затем через катетер вводят губку — ее частички оседают между витками. Их применяют только для остановки кровотечений, обусловленных опухолями.
- Химиоэмболизация — введение в просвет сосуда эмболов, содержащих химиопрепарат. Таким образом, с одной стороны происходит закупорка сосудов, кровоснабжающих опухоль, а с другой химиопрепарат поступает непосредственно в ткань опухоли и не оказывает побочные эффекты, которые возникают при его введении в вену. При этом в самой опухоли создаются очень высокие концентрации препарата, невозможные при обычном введении. Мы применяем самые современные препараты для химиоэмболизации: DC Beads (Terumo, Япония) и Hepaspheres (Merit Medical, США)., которые высвобождают химиопрепарат в течение длительного времени, в стабильной дозировке.
- Радиоэмболизация — введение эмболов, содержащих радиоактивные изотопы. Эта процедура еще называется внутренней лучевой терапией, так как в опухоль изнутри вводят дозу радиации, разрушающей ее клетки. Для этого обычно используют изотоп Иттрий-90.
Эмболизация артерий в онкологии
К эмболизации артерий наиболее часто прибегают при следующих онкологических заболеваниях:
- В качестве самостоятельного метода лечения: Первичные и метастатические опухоли печени, почек, легких и других локализаций.
- В комбинации с хирургическими методами: Первичные и метастатические опухоли печени, почек, легких, костей, позвоночника, матки, простаты, мочевого пузыря и т. д.
- Для остановки кровотечений при опухолях: малого таза, легких, прямой кишки, толстой кишки, печени, матки, простаты, опухолях головы и шеи. Т. е. практически при любой локализации с целью прекращения кровотечения.
Эмболизация также широко применяется для лечения заболеваний, не связанных с онкологией:
- Миома матки. Эмболизация маточных артерий — наименее травматичный способ лечения миомы матки, обладающий высокой эффективностью — около 98,5% женщин, перенесших эту процедуру, не нуждаются в дополнительном лечении.
- Аденома простаты. Эмболизация — эффективный, малоинвазивный способ лечения аденомы предстательной железы, который сегодня становится все более распространен в развитых странах.
- Варикоцеле — наименее инвазивная альтернатива хирургическому лечению, выполняется амбулаторно за 20-30 минут.
- Сосудистые мальформации различной локализации.
- Аневризмы — в первую очередь аневризмы головного мозга, способные вызвать геморрагический инсульт.
Насколько безопасна эмболизация?
Цель эмболизации в онкологии — не только прекратить приток крови к патологическому очагу, но и сохранить при этом кровообращение в соседних здоровых тканях. Современная техника эмболизации с использованием микрокатетеров позволяет обеспечить необходимую точность эмболизации.
Для того чтобы обеспечить точность в ходе эмболизации всегда проводят ангиографию. Врач внимательно изучает сосудистую сеть, кровоснабжение опухоли и определяет, в какой сосуд должны быть введены эмболы. Эмболы вводятся только после детального изучения сосудистой анатомии опухоли в ходе вмешательства. Перед эмболизацией вам также могут назначить УЗИ, КТ, МРТ и другие исследования.
Существует ряд противопоказаний к проведению эмболизации, но все они являются относительными, то есть процедура, как правило, все же может быть проведена при соблюдении некоторых условий. Например, у пациента с нарушением функции почек должно быть нормализовано артериальное давление, водно-солевой баланс, а во время ангиографии нужно использовать минимальное количество контрастного вещества.
В Европейской клинике с каждым пациентом работают индивидуально. Врач оценивает общее состояние больного, учитывает сопутствующие заболевания, размеры и расположение опухоли, особенности ее кровоснабжения.
Врачи-специалисты Европейской клиники имеют огромный опыт проведения эмболизации артерий при различных видах опухолей. Мы используем значительный собственный и опыт коллег из ведущих зарубежных клиник. Некоторые процедуры, которые мы предлагаем пациентам в Европейской клинике (например, эмболизация при аденоме простаты), даже в Европе, США и Израиле являются прерогативой крупных университетских клиник из-за необходимости иметь хирургов самого высокого уровня.
Нашими врачами были выполнены первые в России эмболизации миомы матки, артерий простаты, мы первыми стали работать с самыми современными препаратами для эмболизации — Bead Block, Embozene, DC Bead и др.
Источник
Суперселективная эмболизация артерий мочевого пузыря в лечении рецидивирующей макрогематурии при опухолях мочевого пузыря
1 Факультет фундаментальной медицины МГУ им. М. В. Ломоносова, кафедра урологии и андрологии (зав. каф. — акад. РАН, проф., д.м.н. Камалов А. А.), Москва, Россия; 2 МНОЦ МГУ им. М. В. Ломоносова (дир. — акад. РАН, проф., д.м.н. Камалов А.А.), Москва, Россия; 3 РНИМУ им. Н. И. Пирогова (ректор — акад. РАН, проф. Лукьянов С. А.), Москва, Россия; 4 ГБУЗ «ГКБ № 31» ДЗМ (глав. врач — к.м.н. Ефремова Н. М.), Москва, Россия
Распространенность рака мочевого пузыря в России за последние 10 лет выросла с 49,6 до 74,1 больного на 100 тыс. населения. Гематурия является жизнеугрожающим осложнением и одной из частых причин летальности при поздних стадиях рака мочевого пузыря. Консервативные методы гемостаза не всегда позволяют достигать стойкого эффекта. При некупируемом кровотечении пациенту показано оперативное лечение. В связи с преобладанием в структуре заболеваемости раком мочевого пузыря пациентов группы высокого анестезиологического риска наиболее предпочтительно применение минимально инвазивных технологий гемостаза. Данный литературный обзор посвящен одному из таких методов — суперселективной эмболизации артерий мочевого пузыря.
Актуальность исследования
Распространенность рака мочевого пузыря в России за последние 10 лет выросла с 49,6 до 74,1 больного на 100 тыс. населения. По росту первичной заболеваемости среди онкоурологических заболеваний рак мочевого пузыря занимает 3-е место после рака простаты и рака почки [1]. Согласно данным мировой статистики по первичной заболеваемости и смертности среди онкоурологических заболеваний, рак мочевого пузыря занимает 2-е место после рака простаты [2].
Одним из тяжелых осложнений и частой причиной летальности при поздних стадиях рака мочевого пузыря служит тотальная макрогематурия. Некупируемая макрогематурия встречается примерно у 10% пациентов [3-6]. Консервативные методы гемостаза не всегда позволяют достигать стойкого эффекта. При некупируемом кровотечении пациенту показано оперативное лечение. Наиболее широкое распространение в данном случае имеют эндоскопические коагуляционные методики, лигирование внутренних подвздошных артерий, а также открытые хирургические вмешательства вплоть до цистэктомии [7, 8].
Между тем стандартные трансуретральные методы гемостаза не лишены недостатков. Трансуретральная электрохирургическая резекция мочевого пузыря и коагуляция кровоточащих сосудов в условиях плохой визуализации из-за продолжающегося кровотечения могут быть причиной массы осложнений вплоть до перфорации мочевого пузыря и в обязательном порядке требует анестезиологического пособия. Лапароскопическое или открытое лигирование внутренней подвздошной артерии и ее ветвей также требует общего наркоза, не всегда бывает достаточно эффективным и делает невозможным выполнение в последующем эндоваскулярного гемостаза. Ретгеноэндоваскулярная эмболизация передней порции внутренней подвздошной артерии не имеет противопоказаний по анестезиологическому риску, однако ввиду недостаточной селективности зачастую неэффективна и связана с ишемией органов малого таза. Предпочтительным минимально-инвазивным хирургическим методом гемостаза для пациентов группы высокого анестезиологического риска с продолжающимся кровотечением из опухоли мочевого пузыря считается суперселективная эмболизация артерий [9].
Обзор литературы
Технологический прогресс позволил существенно расширить возможности рентгеноэндоваскулярной хирургии, которую стали использовать как метод не только диагностики, но и лечения, одним из вариантов которого служит рентгеноэндоваскулярная эмболизация артерий. Впервые в мире эту методику применил R. H. M. Dawbarn в 1904 г. [10] при злокачественной опухоли наружной сонной артерии.
В качестве эмболизационного материала была использована смесь парафина и вазелина. Родоначальниками применения рентгеноэндоваскулярной эмболизации в урологии стали А. F. Lalli et al. [11], в 1969 г. впервые экспериментально выполнившие эмболизацию почечной артерии. В 1973 г. L. E. Almgard et al. [12] впервые применили данную методику в клинической практике. Эмболизационным материалом послужила гомогенизированная аутомыщца. В 1979 г. E. K. Lang et al. [13] сообщили об успешном выполнении билатеральной эмболизации передней порции внутренней подвздошной артерии 14 пациентам с тотальной макрогематурией. В России первопроходцами в области эндоваскулярной эмболизации в урологии стали А. М. Гранов (1979) [14], Н. А. Лопаткин (1982) [15], В. С. Рябинский (1985) [16], применившие данную технику для эндоваскулярной окклюзии почечной артерии. Эмболизация для остановки кровотечения из артерий мочевого пузыря впервые была применена T. D. Schuhrke et al. в 1976 г. [17]. В нашей стране подобный опыт в 1985 г. впервые представили А. М. Гранов и соавт. [18], успешно выполнившие эмболизацию передней порции внутренней подвздошной артерии 30 пациентам с продолжающимся кровотечением из опухоли мочевого пузыря. Опыт успешного выполнения рентгеноэндоваскулярной суперселективной эмболизации артерий мочевого пузыря (ССЭАМП) 80 пациентам с некупируемой макрогематурией в 2013 г. представили А. М. Тибилов и соав…
В.К. Карпов, С.А. Капранов, Б.М. Шапаров, А.А. Камалов
Источник
Что такое сосудистая эмболизация?
23 декабря 2020

Это рентгенохирургическая процедура, которая используется и в онкологии для ухудшения кровоснабжения опухолевых тканей. Злокачественное новообразование формирует вокруг себя сеть сосудов, по которым к нему поступает кислород и питательные вещества, необходимые для размножения клеток опухоли. Эмболизация, то есть закупорка, перекрытие таких сосудов оставляет новообразование без притока крови, что ведет к постепенной остановке его роста за счет отмирания злокачественных клеток.
Как проводят эту процедуру?
Эмболизация — это малоинвазивный, то есть не связанный с масштабными хирургическими вмешательствами, метод лечения. Иногда он может даже послужить альтернативой традиционной операции.
Доступ к области, в которой находится опухоль, врачи получают через крупные сосуды человеческого тела, расположенные по соседству. Через очень небольшой разрез в тот или иной сосуд вводят катетер и медленно перемещают его к новообразованию. Вся эта процедура проходит под контролем рентгеноскопии — врач видит, куда и насколько он продвигает катетер.
По достижении сосуда, питающего опухоль, через катетер вводят эмбол — вещество или устройство, которые призваны закупорить сосуд, остановить кровообращение в нем. После этого делают несколько ангиографических снимков для того, чтобы удостовериться, что операция прошла успешно, и эмбол установлен именно там, где требовалось. Чаще всего такие вмешательства проходят под местной анестезией, но иногда, например, при эмболизации опухолей в печени, используют и общий наркоз.
Какие есть типы эмболизирующих материалов?
- жидкие среды, которые способны легко проникать в сложные разветвления мелких сосудов, обеспечивая повышенную точность воздействий;
- склерозирующие материалы — они не создают искусственную «пробку», а уплотняют внутренний клеточный слой сосуда, за счет чего его просвет постепенно перекрывается;
- эмболизирующие микрочастицы;
- устройства для механической закупорки сосуда: спирали, баллоны и т.д.
Наиболее эффективным способом сосудистой эмболизации в современной онкологии считается химиоэмболизация с использованием микросфер. Микросферы представляют собой полимерные частицы шарообразной формы и диаметром от 50 до 200 мкм. Их диаметр также можно подбирать в зависимости от ожидаемого размера сосудов, питающих опухоль. После введения эти частицы «застревают» в просвете сосудов, вызывая их необратимую эмболизацию. Кроме того, перед вмешательством микросферы также насыщают препаратами для химиотерапии. После закупорки сосуда они начинают высвобождать эти цитостатические лекарственные вещества и могут поддерживать их терапевтическую концентрацию до месяца.
При каких онкозаболеваниях показана сосудистая эмболизация?
Эмболизацию с использованием микросфер и одновременным применением препаратов для химиотерапии назначают при:
- первичном раке печени;
- печеночных метастазах опухолей нервной системы, желез внутренней секреции и прямой кишки;
- опухолях желчного пузыря и желчевыводящих протоков;
- раке молочной железы;
- опухолях легких;
- почечном раке;
- раке головки поджелудочной железы;
- опухолях костных структур головы и шеи.
Каковы преимущества сосудистой эмболизации?
- Малая инвазивность процедуры — она не требует наложения швов и не оставляет после себя крупных послеоперационных шрамов.
- Минимальный риск инфекционных осложнений.
- Часто нет необходимости использовать общую анестезию, которая всегда становится серьезной нагрузкой для ослабленного организма онкобольного.
- Минимальное время восстановления после вмешательства.
- Высокая эффективность в сравнении с традиционной системной химиотерапией.
- Сохранение целостности и функциональной активности органов и тканей.
Как проходит сосудистая эмболизация в клинике «Анадолу»?
Специалисты нашего медицинского центра используют самые современные эмболизационные материалы, а потому этот метод онкологического лечения дает отличные результаты. Кроме того, очень многое зависит от профессионализма врачей, проводящих данную процедуру. В клинике «Анадолу» сосудистую эмболизацию выполняет целая команда высококвалифицированных специалистов: хирург-онколог, химиотерапевт, сосудистый хирург, а также интервенционный радиолог, который обеспечивает контроль введения катетера.
Источник
Лечение рака мочевого пузыря
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последнего поколения с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название — переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа — уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1-2% случаев (по данным Американского онкологического сообщества — American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев — аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев — мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы — злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N — наличие очагов поражения в регионарных лимфоузлах, M — наличие отдаленных метастазов в других органах.

В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 — неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии — это инвазивный рак.
- Стадия I — опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II — опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III — злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1-3), отдаленных метастазов нет (M0).
- Стадия IV — злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
Важно внимательно относиться к своему здоровью, обращать внимание на любые симптомы, которые сохраняются в течение длительного времени, и при их возникновении сразу обращаться к врачу.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
- Цитологическое исследование мочи — её изучение под микроскопом на предмет наличия опухолевых клеток. Этот анализ иногда помогает диагностировать рак на ранних стадиях, но он не идеален.
- Исследование мочи на онкомаркеры — вещества, повышение уровней которых может свидетельствовать о злокачественной опухоли. Это также не совсем надежный тест.
- Цистоскопия — эндоскопическое исследование мочевого пузыря, когда в орган вводят специальный инструмент — цистоскоп — с видеокамерой. Наиболее информативна так называемая цистоскопия с синим светом. В мочевой пузырь вводят специальный препарат, который накапливается в опухолевых клетках и заставляет их флуоресцировать («светиться») в лучах синего света.
- Биопсия — исследование, во время которого получают фрагмент патологически измененной ткани и изучают в лаборатории под микроскопом. Это самый надежный способ разобраться, присутствуют ли в патологическом образовании раковые клетки, и является ли оно злокачественным. Материал для биопсии можно получить во время цистоскопии.
- Внутривенная пиелография. Пациенту внутривенно вводят раствор рентгеноконтрастного препарата, который затем начинает выводиться почками и «прокрашивает» мочевыводящие пути на рентгеновских снимках. Это помогает обнаружить опухоли.
- Ретроградная пиелография — исследование, во время которого рентгеноконтрастный раствор вводят через катетер, установленный в мочевом пузыре или мочеточнике.
- Ультразвуковое исследование помогает оценить размеры опухоли, выяснить, не распространилась ли она за пределы мочевого пузыря, проверить состояние почек. Под контролем УЗИ в обнаруженную опухоль можно ввести иглу и провести биопсию.
- Компьютерная томография и МРТ помогают оценить размеры, расположение, количество опухолевых очагов, обнаружить распространение рака на соседние органы, в лимфатические узлы, выявить метастазы. Под контролем КТ также можно провести биопсию с помощью иглы.
- Рентгенографию применяют для поиска метастазов в легких, костях.
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Как выбирают лечение при раке мочевого пузыря?
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
Хирургическое лечение
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент — резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
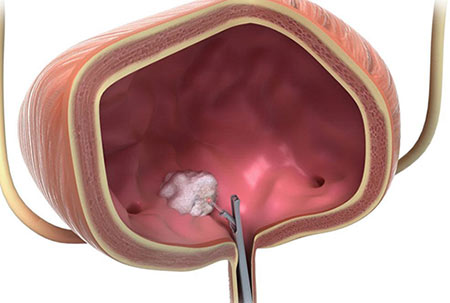
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию — удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.
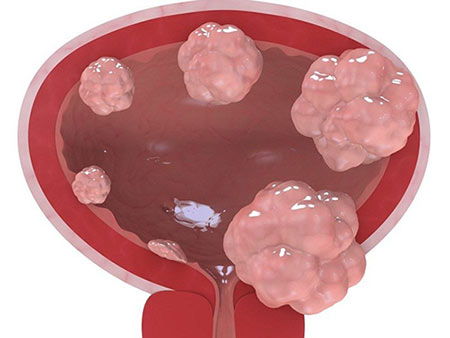
Большинству больных приходится выполнять цистэктомию — полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин — семенные пузырьки и простату, у женщин — матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения — когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция — когда хирург подсоединяет к одному концу кишки мочеточники, а к другому — мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиотерапия
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
- Неоадъювантную химиотерапию проводят до хирургического вмешательства. Благодаря препаратам опухоль уменьшается, и ее становится проще удалить.
- Адъювантная химиотерапия применяется после операции. Если в организме пациента остались раковые клетки, химиопрепараты их уничтожают, за счет этого снижается риск рецидива.
- Химиолучевая терапия — когда химиопрепараты назначают «в помощь» лучевой терапии. За счет этого повышается эффективность лечения рака.
- Паллиативная химиотерапия — один из основных методов лечения на поздних стадиях, когда опухоль неоперабельна, имеются отдаленные метастазы. Химиопрепараты помогают продлить жизнь пациента и избавить от некоторых симптомов.
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.
Лучевая терапия
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Иммунотерапия рака мочевого пузыря
Иммунитет человека умеет уничтожать не только болезнетворные микроорганизмы, проникшие извне, но и собственные клетки, в генах которых возникли «ошибки». Именно из-за таких «ошибок» нормальная клетка превращается в раковую. Однако, опухолевые клетки умеют «обманывать» иммунитет, и используют для этого сложные молекулярные механизмы.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2-3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10-15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса — для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухол