Химиотерапия и лучевая терапия рака мочевого пузыря
Содержание статьи
Адъювантная химио- и иммунотерапия при раке мочевого пузыря
Лечение рака мочевого пузыря (стадии Та, T1, Cis)
Адъювантная химио- и иммунотерапия
Несмотря на то что радикально выполненная ТУР, как правило, позволяет полностью удалить поверхностные опухоли мочевого пузыря, тем не менее, они часто (в 30-80% случаев) рецидивируют, а у части больных заболевание прогрессирует.
На основании результатов 24 рандомизированных исследований, в которых участвовали 4863 больных с поверхностными опухолями мочевого пузыря, Европейская организация по исследованию и лечению рака мочевого пузыря в 2007 г. разработала методику проспективной оценки риска рецидивирования и прогрессирования опухолей. В основе методики лежит 6-балльная система оценки нескольких факторов риска: количество опухолей, максимальные размеры опухоли, частота рецидивов в анамнезе, стадия заболевания, наличие CIS, степень дифференциации опухоли. По сумме этих баллов определяют риск рецидивирования или прогрессирования заболевания в %.
Система расчёта факторов риска рецидивирования и прогрессирования поверхностных опухолей мочевого пузыря
Фактор риска | Рецидивирование | Прогрессирование |
Количество опухолей | ||
Единственная | ||
От 2 до 7 | 3 | 3 |
28 | б | 3 |
Диаметр опухоли | ||
23 см | 3 | 3 |
Отмечаемое ранее рецидивирование | ||
первичный рецидив | ||
менее 1 рецидива в год | 2 | 2 |
более 1 рецидива в год | 4 | 2 |
Стадия заболевания | ||
Та | ||
Т1 | 1 | 4 |
CIS | ||
Нет | ||
Есть | 1 | 6 |
Степень дифференцировки | ||
G1 | ||
G2 | 1 | |
G3 | 2 | 5 |
Всего баллов | 0-17 | 0-23 |
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Группы поверхностных опухолей мочевого пузыря в соответствии с факторами риска
- Опухоли малого риска:
- единственные;
- Та;
- высокодифференцированные;
- размером
- Опухоли высокого риска:
- Т1;
- низкодифференцированные;
- множественные;
- высокорецидивные;
- CIS.
- Опухоли промежуточного риска:
- Та-Т1;
- среднедифференцированные;
- множественные;
- размером >3 см.
Из приведённых выше данных становится понятной необходимость адъювантной химио- или иммунотерапии после ТУР мочевого пузыря практически у всех больных с поверхностным раком.
Цели и предположительные механизмы местной химио- и иммунотерапии заключаются в предупреждении имплантации раковых клеток в ранние сроки после ТУР. уменьшении возможности рецидивирования или прогрессирования заболевания и абляции резидуальной опухолевой ткани при неполном её удалении («гемиреэекция»).
Внутрипузырная химиотерапия
Существуют две схемы внутрипузырной химиотерапии после ТУР мочевого пузыря по поводу поверхностного рака: однократная инсталляция в ранние сроки после операции (в течение первых 24 ч) и адъювантное многократное введение химиопрепарата.
Однократная инстилляция в ранние сроки после операции
Для внутрипузырной химиотерапии с одинаковым успехом применяют митомицин, эпирубицин и доксорубицин. Внутрипузырное введение химиопрепаратов осуществляют при помощи уретрального катетера. Препарат разводят в 30-50 мл 0.9% раствора натрия хлорида (или дистиллированной воды) и вводят в мочевой пузырь на 1-2 ч. Обычные дозы для митомицина составляют 20-40 мг, для эпирубицина — 50-80 мг. для доксорубицина 50 мг. С целью предупреждения разведения препарата мочой больным в день инстилляции резко ограничивают приём жидкости. Для лучшего контакта химиопрепарата со слизистой оболочкой мочевого пузыря рекомендуют часто менять положение тела до мочеиспускания.
При использовании митомицина следует учитывать возможность аллергической реакции с покраснением кожи ладоней и гениталий (у 6% больных), что легко предупредить тщательным мытьём рук и гениталий сразу же вслед за первым мочеиспусканием после инстилляции препарата. Серьёзные местные и даже системные осложнения обычно возникают при экстравазации препарата, поэтому ранняя инсталляция (в течение 24 ч после ТУР) противопоказана при подозрении на вне- или внутрибрюшинную перфорацию мочевого пузыря, что обычно может происходить при агрессивной ТУР мочевого пузыря.
В связи с опасностью системного (гематогенного) распространения местная химио- и иммунотерапия противопоказаны также при макрогематурии. Однократная инсталляция химиопрепарата снижает риск рецидивирования на 40-50%, на основании чего её осуществляют практически у всех больных. Однократное введение химиопрепарата в более поздние сроки уменьшает эффективность метода в 2 раза.
Снижение частоты рецидивирования происходит в течение 2 лет, что имеет особое значение у больных с малым онкологическим риском, для которых однократная инсталляция стала основным методом метафилактики. Однако однократная инсталляция недостаточна при среднем и, особенно, высоком онкологическом риске, и такие больные в связи с большой вероятностью рецидивирования и прогрессирования заболевания нуждаются в дополнительной адъювантной химио- или иммунотерапии.
Адъювантное многократное введение химиопрепарата
Лечение рака мочевого пузыря заключается в многократном внутрипузырном введении тех же химиопрепаратов. Химиотерапия эффективна с точки зрения уменьшения риска рецидивирования. но недостаточно эффективна для предупреждения прогрессирования опухоли. Данные об оптимальной продолжительности и частоте внутрипузырной химиотерапии противоречивы. Согласно рандомизированному исследованию
Европейской организации по исследованию и лечению рака мочевого пузыря, ежемесячная инсталляция в течение 12 мес не улучшала результаты лечения по сравнению с таковой в течение 6 мес при условии, что первую инсталляцию осуществляли сразу после ТУР Согласно другим рандомизированным исследованиям. частота рецидивирования при годовом курсе лечения (19 инсталляций) была ниже по сравнению с 3-месячным курсом (9 инстилляции) приёма эпирубицина.
[12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24]
Внутрипузырная иммунотерапия
Для больных с поверхностным раком мочевого пузыря с высоким риском рецидивирования и прогрессирования наиболее эффективный метод метафилактики внутрипузырная иммунотерапия вакциной БЦЖ, введение которой приводит к выраженному иммунному ответу: в моче и стенке мочевого пузыря происходит экспрессия цитокинов (интерферон у, интерлейкин-2 и др.). стимуляция клеточных факторов иммунитета. Этот иммунный ответ активирует цитотоксические механизмы, которые составляют основу эффективности БЦЖ в предупреждении рецидивирования и прогрессирования заболевания.
Вакцина БЦЖ состоит из ослабленных микобактерий. Её разработали в качестве вакцины для туберкулёза, но она также обладает противоопухолевой активностью. Вакцина БЦЖ — лиофилизированный порошок, который хранят в замороженном виде. Её выпускают различные фирмы, но все производители используют культуру микобактерий. полученную в институте Пастера во Франции.
Вакцину БЦЖ разводят в 50 мл 0,9% раствора натрия хлорида и сразу же вводят в мочевой пузырь по уретральному катетеру под силой тяжести раствора. Адъювантное лечение рака мочевого пузыря начинают через 2-4 нед после ТУР мочевого пузыря (время, необходимое для реэпителизации) для уменьшения риска гематогенного распространения живых бактерий. В случае травматичной катетеризации процедуру инстилляции откладывают на несколько дней. После инстилляции в течение 2 ч больной не должен мочиться, необходимо часто менять положение тела для полноценного взаимодействия препарата со слизистой оболочкой мочевого пузыря (повороты с одного бока на другой). В день инстилляции следует прекратить приём жидкости и диуретиков для уменьшения разведения препарата мочой.
Больных следует предупредить о необходимости мытья унитаза после мочеиспускания, хотя риск бытовой контаминации считают гипотетическим. Несмотря на преимущества БЦЖ по сравнению с адъювантной химиотерапией, общепризнано, что иммунотерапия рекомендована лишь больным с высоким онкологическим риском. Это связано с вероятностью развития различных, в том числе и грозных, осложнений (цистит, подъём температуры, простатит, орхит, гепатит, сепсис и даже летальный исход). Из-за развития осложнений часто приходится прекращать адъювантную терапию. Именно поэтому её назначение больным с низким онкологическим риском не оправданно.
Основные показания к назначению вакцины БЦЖ:
- CIS;
- наличие резидуальной опухолевой ткани после ТУР;
- метафилактика рецидивиривания опухолей у больных с высоким онкологическим риском.
Большое значение придают применению вакцины БЦЖ у больных с высоким риском прогрессирования заболевания, так как доказано, только этот препарат способен уменьшить риск или отстрочить прогрессирование опухоли.
Абсолютные противопоказания к БЦЖ-терапии:
- иммунодефицит (например, на фоне приёма цитостатиков);
- сразу после ТУР;
- макрогематурия (риск гематогенной генерализации инфекции, сепсиса и смерти);
- травматичная катетеризация.
[25], [26], [27], [28], [29], [30], [31], [32], [33], [34]
Относительные противопоказания к БЦЖ-терапии:
- инфекция мочевыводящих путей;
- заболевания печени, исключающие возможность применения изониазида в случае туберкулёзного сепсиса;
- туберкулёз в анамнезе;
- тяжёлые сопутствующие заболевания.
Классическую схему адъювантной БЦЖ-терапии эмпирически разработал Morales более 30 лет тому назад (еженедельная инсталляция в течение 6 нед). Однако в дальнейшем установили, что 6-недельного курса лечения недостаточно. Существуют несколько вариантов этой схемы: от 10 инсталляций в течение 18 нед до 30 инсталляций в течение 3 лет. Хотя оптимальная общепризнанная схема применения БЦЖ ещё не разработана, большинство экспертов сходятся во мнении, что при её хорошей переносимости продолжительность лечения должна
составлять не менее 1 года (после первого 6-недельного курса проводят повторные 3-недельные курсы через 3, 6 и 12 мес).
Рекомендации по внутрипузырной химио- или БЦЖ-терапии
- При низком или среднем риске рецндивирования и очень низком риске прогрессирования необходимо обязательно осуществлять однократную инсталляцию химнопрепарата.
- При низком или среднем риске прогрессирования независимо от степени риска рециднвнровання. после однократного введения химнопрепарата необходима поддерживающая адъювантная внутрипузырная химио- (6-12 мес) или иммунотерапия (БЦЖ в течение 1 года).
- При высоком риске прогрессирования показана внутрипузырная иммунотерапия (БЦЖ по крайней мере в течение 1 года) либо немедленная радикальная цистэктомия.
- При выборе той или иной терапии необходимо оценивать возможные осложнения.
Лечение рака мочевого пузыря (стадии Т2, ТЗ, Т4)
Лечение рака мочевого пузыря (стадии Т2, ТЗ, Т4) — системная химиотерапия рака мочевого пузыря.
Примерно у 15% больных при выявлении рака мочевого пузыря также диагностируют региональные либо отдалённые метастазы, и почти у половины больных метастазирование происходит после радикальной цистэктомии или лучевой терапии. Без дополнительного лечения выживаемость таких больных незначительная.
Основной химиопрепарат при системной химиотерапии цисплатин, однако в виде монотерапии результаты лечения значительно уступают таковым по сравнению с комбинированным применением этого препарата с метотрексатом, виноластином и доксорубицином (MVAC). Однако лечение рака мочевого пузыря MVAC сопровождается выраженной токсичностью (смертность на фоне лечения составляет 3-4%).

В последние годы предложили использовать новый химиопрепарат гемцитабин в сочетании с цисплатином, что позволило достичь аналогичных MVAC результатов при существенно меньшей токсичности.
Комбинированная химиотерапия у 40-70% больных частично или полностью эффективна, что и послужило основанием для её применения в сочетании с иистэктомией или лучевой терапией в режиме неоадъювантной или адъювантной терапии.
Неоадъювантиая комбинированная химиотерапия Показана больным со стадией Т2-Т4а до радикальной цистэктомии или лучевого лечения и направлена на лечение рака мочевого пузыря возможных микрометастазов, снижение вероятности реиидивирования. а у части больных на сохранение мочевого пузыря. Больные переносят её легче до основного лечения (цистэктомия или облучение), однако рандомизированные исследования выявили её незначительную эффективность либо отсутствие таковой. У некоторых больных (опухоль малых размеров. отсутствие гидронефроза, папиллярное строение опухоли, возможность полного визуального удаления опухоли путём ТУР) в 40% случаев адъювантная химиотерапия в сочетании с облучением позволила избежать цистэктомии, однако для подобной рекомендации необходимы рандомизированные исследования.
Адъювантная системная химиотерапия
Различные её схемы (стандартный режим MVAC, те же препараты в высоких дозах, гемцитабин в сочетании с цисплатином) находятся на стадии изучения в рандомизированном исследовании Европейской организации по исследованию и лечению рака мочевого пузыря, что пока не позволяет рекомендовать один из её вариантов.
Схема MVAC при метастатическом поражении была эффективна лишь > 15-20% больных (продление жизни только на 13 мес). При этом результаты были лучше у больных с метастазированием в региональные лимфатические узлы по сравнению с метастазированием в отдалённые органы. При неэффективности сочетания MVAC была выявлена высокая эффективность замены режима на гемцитабин и паклитаксел. В качестве первичной терапии хорошие результаты были получены при сочетании цисплатина гемцитабина и паклитаксела.
В заключении следует отметить, что системная химиотерапия не показана пои инвазивном раке мочевого пузыря без наличия метастазов. Оптимальные показания к её применению можно будет определить только после завершения рандомизированных исследований.
[35], [36], [37], [38], [39], [40], [41], [42], [43], [44], [45], [46]
Источник
Лечение рака мочевого пузыря
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последнего поколения с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название — переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа — уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1-2% случаев (по данным Американского онкологического сообщества — American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев — аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев — мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы — злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N — наличие очагов поражения в регионарных лимфоузлах, M — наличие отдаленных метастазов в других органах.

В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 — неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии — это инвазивный рак.
- Стадия I — опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II — опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III — злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1-3), отдаленных метастазов нет (M0).
- Стадия IV — злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
Важно внимательно относиться к своему здоровью, обращать внимание на любые симптомы, которые сохраняются в течение длительного времени, и при их возникновении сразу обращаться к врачу.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
- Цитологическое исследование мочи — её изучение под микроскопом на предмет наличия опухолевых клеток. Этот анализ иногда помогает диагностировать рак на ранних стадиях, но он не идеален.
- Исследование мочи на онкомаркеры — вещества, повышение уровней которых может свидетельствовать о злокачественной опухоли. Это также не совсем надежный тест.
- Цистоскопия — эндоскопическое исследование мочевого пузыря, когда в орган вводят специальный инструмент — цистоскоп — с видеокамерой. Наиболее информативна так называемая цистоскопия с синим светом. В мочевой пузырь вводят специальный препарат, который накапливается в опухолевых клетках и заставляет их флуоресцировать («светиться») в лучах синего света.
- Биопсия — исследование, во время которого получают фрагмент патологически измененной ткани и изучают в лаборатории под микроскопом. Это самый надежный способ разобраться, присутствуют ли в патологическом образовании раковые клетки, и является ли оно злокачественным. Материал для биопсии можно получить во время цистоскопии.
- Внутривенная пиелография. Пациенту внутривенно вводят раствор рентгеноконтрастного препарата, который затем начинает выводиться почками и «прокрашивает» мочевыводящие пути на рентгеновских снимках. Это помогает обнаружить опухоли.
- Ретроградная пиелография — исследование, во время которого рентгеноконтрастный раствор вводят через катетер, установленный в мочевом пузыре или мочеточнике.
- Ультразвуковое исследование помогает оценить размеры опухоли, выяснить, не распространилась ли она за пределы мочевого пузыря, проверить состояние почек. Под контролем УЗИ в обнаруженную опухоль можно ввести иглу и провести биопсию.
- Компьютерная томография и МРТ помогают оценить размеры, расположение, количество опухолевых очагов, обнаружить распространение рака на соседние органы, в лимфатические узлы, выявить метастазы. Под контролем КТ также можно провести биопсию с помощью иглы.
- Рентгенографию применяют для поиска метастазов в легких, костях.
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Как выбирают лечение при раке мочевого пузыря?
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
Хирургическое лечение
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент — резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
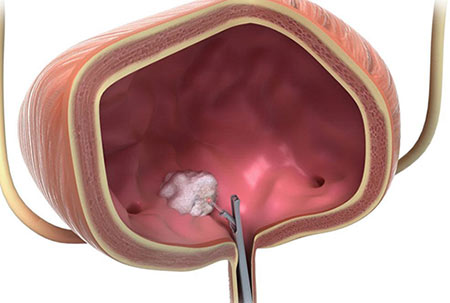
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию — удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.
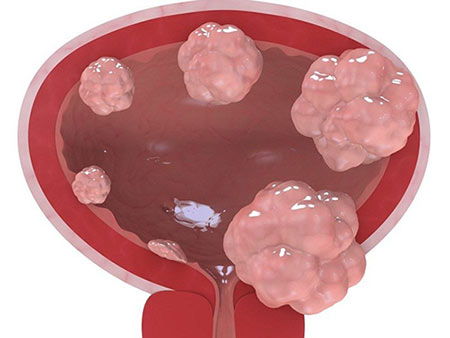
Большинству больных приходится выполнять цистэктомию — полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин — семенные пузырьки и простату, у женщин — матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения — когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция — когда хирург подсоединяет к одному концу кишки мочеточники, а к другому — мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиотерапия
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
- Неоадъювантную химиотерапию проводят до хирургического вмешательства. Благодаря препаратам опухоль уменьшается, и ее становится проще удалить.
- Адъювантная химиотерапия применяется после операции. Если в организме пациента остались раковые клетки, химиопрепараты их уничтожают, за счет этого снижается риск рецидива.
- Химиолучевая терапия — когда химиопрепараты назначают «в помощь» лучевой терапии. За счет этого повышается эффективность лечения рака.
- Паллиативная химиотерапия — один из основных методов лечения на поздних стадиях, когда опухоль неоперабельна, имеются отдаленные метастазы. Химиопрепараты помогают продлить жизнь пациента и избавить от некоторых симптомов.
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.
Лучевая терапия
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Иммунотерапия рака мочевого пузыря
Иммунитет человека умеет уничтожать не только болезнетворные микроорганизмы, проникшие извне, но и собственные клетки, в генах которых возникли «ошибки». Именно из-за таких «ошибок» нормальная клетка превращается в раковую. Однако, опухолевые клетки умеют «обманывать» иммунитет, и используют для этого сложные молекулярные механизмы.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2-3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10-15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса — для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухоли, состояния здоровья пациента, наличия и отсутствия у него противопоказаний.
Оптимальные методы лечения злокачественных опухолей мочевого пузыря прописаны в специальных документах — протоколах. Они составлены на основе результатов многочисленных клинических исследований с участием тысяч пациентов по всему миру и регулярно пересматриваются, обновляются.
Врачи в Европейской клинике руководствуются последними версиями американских, европейских, израильских протоколов лечения.
Насколько эффективны современные методы лечения, каков прогноз?
В среднем в течение 5 лет остаются в живых 77% пациентов, в течение 10 лет — 70%, в течение 15 лет — 65%. Пятилетняя выживаемость при злокачественных опухолях мочевого пузыря зависит от стадии:
- Стадия 0-98%.
- Стадия I-88%.
- Стадия II-63%.
- Стадия III-46%.
- Стадия IV-15%.
В настоящее время проводятся клинические исследования, врачи ищут более эффективные способы борьбы с заболеванием, а значит, есть надежда, что в ближайшем будущем эти показатели улучшатся.
Источник