Гемзар рак мочевого пузыря
Органосохраняющее лечение инвазивного рака мочевого пузыря
Лечение инвазивного рака мочевого пузыря — актуальная проблема онкоурологии. Стандартным видом лечения в этой ситуации остается радикальная цистэктомия с различными методами деривации мочи. Вместе с тем существует множество публикаций о возможности проведения органосохраняющее лечения, результаты которого в определенных группах пациентов не уступают таковым после удаления органа. Сочетание эндоскопической хирургии, химио-, лучевой терапии позволяет не только добиться высоких показателей отдаленной выживаемости, но и сохранить собственный функционирующий мочевой пузырь.
Появление в клинической практике химиопрепаратов (гемцитабин, таксаны) высокоэффективных в отношении переходно-клеточного рака, дает надежду на повышение эффективности комбинированного лечения больных инвазивным раком мочевого пузыря.
В исследование было включено 69 больных раком мочевого пузыря в стадии Т2а-4аN0M0. Среди них было 59 мужчин и 10 женщин, средний возраст больных — 59 лет. Характеристика больных представлена в табл. 1.
Таблица 1. Характеристика больных
Показатель | ТУР +2 курса ПХТ+ химиолучевая терапия | 3 курса ПХТ + химиолучевая терапия | Всего |
Количество больных, м./ж. | 31 26/5 | 38 33/5 | 69 59/10 |
Средний возраст, годы | 60 | 58 | 59 |
Стадия: | |||
Т2а | 13 | 6 | 19 |
Т2в | 9 | 6 | 15 |
Т3а | 6 | 19 | 25 |
Т3в | 2 | 5 | 7 |
Т4а | 1 | 2 | 3 |
Функция почек: | |||
сохранена | 25 | 27 | 52 |
нарушена | 6 | 11 | 17 |
Степень дифференцировки: | |||
G1 | 6 | 7 | 13 |
G2 | 14 | 19 | 33 |
G3-4 | 11 | 12 | 23 |
Примечание: ТУР — трансуретральная резекция, ПХТ — полихимиотерапия.
В зависимости от местного распространения опухоли больные распределись следующим образом: у 34 (49%) пациентов заболевание было ограничено стенкой мочевого пузыря (Т2а-2в), у 25 (36%) имелась микроинвазия паравезикальной клетчатки (Т3а) и у 10 (15%) — макроскопическое прорастание стенки органа (Т3в) или инвазия предстательной железы (Т4а). Нарушение оттока мочи, связанное со сдавлением одного из устьев мочеточника опухолью, было у 17 (25%) пациентов. После установления диагноза и перед началом специфического лечения 10 (15%) из них выполнена чрескожная пункционная нефростомия под ультразвуковым контролем. У 2 больных выявлена гидронефротическая трансформация с одной стороны. У 5 больных имелась умеренная пиелоэктазия, которая нормализовалась после начала противоопухолевого лечения.
Во всех случаях гистологически верифицирован переходно-клеточный рак. Высокодифференцированные опухоли (G1) были лишь у 13 (19%) больных, в остальных случаях новообразования состояли из умеренно-, низко- и недифференцированных клеток (G2-4).
Исследование носило пилотный характер. Изучали эффективность органосохраняющей терапии. Применяли два варианта лечения. Первый вариант заключался в последовательном выполнении ТУР экзофитной части опухоли, проведении 2 курсов ПХТ и последующей химиолучевой терапии. Показанием для назначения этого метода органосохранной терапии являлось наличие солитарной опухоли, размером не более 5 см, располагающейся в пределах органа, или с наличием микроинвазии окружающей клетчатки (предстательной железы). Схема лечения представлена на рис. 1.
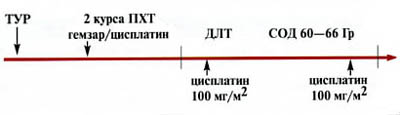
Рис. 1. Схема комбинированного лечения (ТУР, 2 курса химиотерапии, сочетанная химиолучевая терапия) инвазивного рака мочевого пузыря
Целью ТУР было максимальное удаление части новообразования, растущей в просвет органа. Резекция опухоли проводилась последовательно в два этапа. На первом этапе резецировалась экзофитная часть образования, на втором — основание опухоли. После получения гистологического подтверждения мышечной инвазии опухоли больным проводилось два курса системной химиотерапии по схеме гемзар/цисплатин (гемзар — 1000 мг/м2 в 1,8,15-й день, цисплатин — 70 мг/м2 во 2-й день, рецикл — на 29-й день). Для консолидации достигнутого эффекта больным назначалась химиолучевая терапия. Дистанционная лучевая терапия проводилась на ускорителе фирмы «Philips» SL-20 или «Siemens» SL-75 методом дневного дробления дозы на область мочевого пузыря. Дневная доза подводилась дважды по 1 Гр, 5 дней в неделю до суммарной очаговой дозы 60-66 Гр. Размер поля 8х10 или 10х10см. Расстояние «источник — центр ротации» — 100 см. В первую и последнюю 5-дневку проведения лучевой терапии дважды внутривенно вводился цисплатин в дозе 100 мг/м2, сенсибилизирующий опухоль к действию ионизирующего излучения.
Другой вариант комбинированного лечения применялся у больных с опухолями > 5 см либо с мультифокальным поражением мочевого пузыря. Лечение состояло из ряда последовательных этапов (рис. 2).
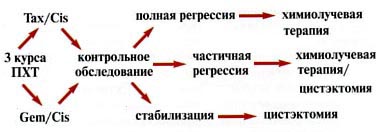
Рис. 2. Схема комбинированного лечения (3 курса химиотерапии + сочетанная химиолучевая терапия) инвазивного рака мочевого пузыря. Tax/Cis — таксотер/цисплатин, Gem/Cis — гемзар/цисплатин
Первоначально всем пациентам назначалось три курса системной ПХТ. Применялись схемы: гемзар/цисплатин и таксотер/цисплатин (таксотер — 75 мг/м2 в 1-й день, цисплатин — 75 мг/м2 в 1-й день, рецикл на 22-й день). Цель неоадъювантной химиотерапии — уменьшение объема опухоли и воздействие на возможные микрометастазы, не определяемые лучевыми методами диагностики. Через 3-4 нед после завершения химиотерапии больных госпитализировали для обследования и продолжения лечения. В случае полной регрессии (ПР) заболевания, проводилась дистанционная лучевая терапия с сочетанным введением цисплатина по той же методике, что и в предыдущей группе. Консервативное лечение также могло быть назначено больным, у которых по данным УЗИ, компьютерной томографии (КТ) и цистоскопии не визуализировалось опухолевых образований, но биопсия из ложа опухоли выявляла микроочаги переходно-клеточного рака. Таким образом, микроскопическое наличие опухоли после неоадъювантной химиотерапии не являлось противопоказанием к проведению консервативного лечения. Решение о продолжении органосохраняющей терапии принималось совместно с пациентом, после обсуждения возможных вариантов лечения и прогноза. При наличии макроскопически определяемых остаточных образований больным рекомендовалось удаление мочевого пузыря.
Непосредственные результаты лечения оценивались через 3 и 6 мес. после его окончания. Для определения объективной регрессии опухоли обязательным являлись пальцевое ректальное исследование, УЗИ, КТ малого таза, цистоскопия с биопсией. Все пациенты, у которых достигнута ПР опухоли через 3 мес после завершения органосохраняющей лечения, оставались под наблюдением. Выявление остаточной опухоли являлось показанием к продолжению лечения. В случае одиночного поверхностного резидуального образования больным выполнялась ТУР с последующей химиотерапией. Если имелась остаточная опухоль без четких границ с признаками инвазивного роста, пациентам предлагалась «спасительная» цистэктомия. Однако при наличии противопоказаний к операции или отказе от удаления мочевого пузыря больным назначалась системная химиотерапия.
Выраженность побочных эффектов в процессе органосохраняющей лечения оценивали по общим критериям токсичности, разработанным Национальным институтом рака США (Common Toxicity Criteria, version 2.0). После окончания терапии больные оставались под наблюдением. Контрольные осмотры проводились через каждые 3 мес в течение первых 2 лет, через 6 мес на 3-м году и затем ежегодно. При наличии остаточной опухоли, рецидива или при прогрессировании болезни этот график изменяли в зависимости от клинической ситуации. Помимо оценки проявлений основного заболевания, во время контрольных осмотров анализировали поздние лучевые реакции. Побочные реакции оценивали по шкале поздних лучевых осложнений, разработанной радиотерапевтической онкологической группой и Европейской организацией по исследованию и лечению рака (RTOG/EORTC Late Radiation Morbidity Scoring Scheme).
Из 69 больных, включенных в исследование, органосохраняющие лечение проведено 64 (92,7%). В их число вошли все пациенты (n=31) 1-й группы, которым проведена комбинированная терапия — ТУР, 2 курса ПХТ гемзар/цисплатин и химиолучевая терапия, а также 33 больных 2-й группы (n=38), в которой применялась комбинация — 3 курса ПХТ + химиолучевая терапия/цистэктомия. 5 больным — после неоадъювантного лечения выполнена радикальная цистэктомия. В табл. 2 представлены результаты 3 курсов системной химиотерапии.
Таблица 2. Регрессия опухоли после неоадъювантной химиотерапии
Схема химиотерапии | Количество больных | ПР | ЧР | Стаби-ли-зация |
Гемзар/ Цисплатин | 20 | 5 | 13 | 2 |
Таксотер/ Цисплатин | 18 | 6 | 12 | — |
Органосохраняющее лечение проведено 11 больным с ПР и 23 пациентам — с частичной регрессией (ЧР) опухоли. Результаты органосохранной терапии, зарегистрированные через 3 и 6 мес после ее окончания, представлены в табл. 3.
Таблица 3. Результаты органосохраняющей терапии
Схема лечения | Количество больных | Результаты лечения, % | |||
через 3 мес | через 6 мес | ||||
ПР | ЧР | ПР | ЧР | ||
ТУР + 2 курса ПХТ+ химиолучевая терапия | 31 | 21 | 10 | 26 | 5 |
3 курса ПХТ + химиолучевая терапия | 38 * | 19 | 14 | 23 | 10 |
* — 5 из этих больных выполнена радикальная цистэктомия.
Количество ПР через 6 мес после завершения лечения возросло, что, вероятно, связано с продолжающейся гибелью опухолевых клеток после химиолучевой терапии, а также с проведением адъювантной терапии. У всех пациентов с ПР после неоадъювантной химиотерапии подтверждено отсутствие опухолевого роста после завершения химиолучевого лечения. Следует отметить удовлетворительную переносимость органосохраняющего лечения. Клинически значимые побочные эффекты суммированы в табл. 4.
Таблица 4. Побочные реакции комбинированного лечения
Токсичность (CTC, version 2.0) | Степень | ТУР + 2 курса ПХТ + химио-лучевая терапия | 3 курса ПХТ + химио-лучевая терапия |
Нейтропения | II-IV | 9 (29) | 11 (29) |
Тромбоци-топения | II-III | 6 (19,4) | 4 (10,5) |
Дизурия | II-III | 1 (3,2) | 2 (6) |
Учащенное мочеиспус-кание | II-III | 1 (3,2) | — |
Примечание: В скобках — процент больных.
Все побочные реакции относительно легко устранялись соответствующим лечением или изменением плана комбинированной терапии.
Редукция доз химиопрепаратов в процессе неоадъювантного лечения потребовалась 24 (34,8%) больным. Дистанционная лучевая терапия доведена до радикальной дозы 60-66 Гр у 60 (93,7%) пациентов. У 4 (6,3%) больных облучение прекращено на СОД 22; 56; 58 и 58 Гр соответственно в связи с развитием острых лучевых реакций III степени тяжести со стороны нижних мочевыводящих путей (дизурия, учащенное мочеиспускание). 46 (71,8%) больным в процессе лучевой терапии дважды вводился цисплатин в дозе 100мг/м2. У 2 пациентов доза редуцирована на 50% в связи с хронической почечной недостаточностью. 16 (25%) пациентам радиосенсибилизация не проводилась, причинами этого были: единственная функционирующая почка (2 больных), печеночная токсичность на неоадъювантном этапе (1), выраженная сердечно-сосудистая патология, лучевая терапия по месту жительства.
Длительность наблюдения в группах больных составила в среднем 34 и 30,2 мес соответственно. Показатели 3-летней общей и скорректированной выживаемости в 1-й группе совпали и были равны 83,3%; во 2-й группе они составили 61,7 и 73,4%.За время наблюдения ни у одного больного не произошло сморщивания мочевого пузыря. Лишь у 2 (3%) пациентов отмечены поздние лучевые циститы II и III степени тяжести.
Мы оценивали также влияние местного распространения опухоли, гистологической дифференцировки опухолевых клеток, наличия пиелоэктазии в связи с опухолью, степени регрессии заболевания на выживаемость больных после органосохраняющей терапии. С этой целью мы объединили обе группы пациентов и сформированы две новые группы. В 1-ю группу вошли больные, у которых опухоль ограничена стенкой мочевого пузыря (Т2а-Т2б), во 2-ю — с распространением опухоли за пределы органа (Т3а-Т4а). По данным однофакторного анализа, влияние на выживаемость имеют стадия Т опухоли и степень ее регрессии после окончания органосохраняющего лечения (табл. 5).
Таблица 5. Влияние факторов прогноза на выживаемость
Критерий прогноза | 3-летняя выжива-емость, % | Однофак-торный анализ (log-rank test) | Много-фак-торный анализ (Cox) | |
Стадия | Т2а-Т2б | 90 | р = 0,02 | р = 0,037 |
Т3а-Т4а | 66 | |||
Степень дифферен-цировки | G1 | 90 | p= 0,921 | p= 0,884 |
G2 | 69 | |||
G3-4 | 84 | |||
Функция почек | Сохранена | 86 | р= 0,067 | р= 0,09 |
Нарушена | 60 | |||
Степень регрессии | ПР | 100 | р=0,001 | р= 0,001 |
ЧР | 45 | |||
Как показал статистический анализ, достоверными критериями (p < 0,05), влияющими на отдаленные результаты лечения, являются: стадии Т2а-Т2бN0M0; ПР опухоли, зарегистрированная через 3 мес после органосохраняющей терапии. Также выявлена тенденция (p < 0,1) к повышению выживаемости больных с сохраненной почечной функцией. Статистически значимого влияния степени дифференцировки опухолевых клеток на эффективность лечения не получено.Эффективность органосохраняющей терапии, продемонстрированная в данном исследовании, в очередной раз подчеркивает правомочность такого подхода. Очевидно, что невозможно проводить прямые сравнения представленных результатов комбинированного лечения с выживаемостью больных после удаления мочевого пузыря. Однако полученные показатели 3-летней выживаемости вполне сопоставимы с эффективностью радикального лечения. Всегда есть пациенты, у которых невозможно сохранить мочевой пузырь и приходится выполнять радикальную цистэктомию. Но определенной группе больных с инвазивным раком мочевого пузыря уже сейчас можно проводить органосохраняющее лечение с положительным результатом.
Разработанное органосохраняющее лечение сопровождалось побочными реакциями, типичными для использованных схем химиотерапии (гемзар/цисплатин, таксотер/цисплатин) и сочетанного химиолучевого воздействия на область мочевого пузыря. Во всех случаях побочные эффекты контролировались своевременным назначением корригирующего лечения или изменением плана органосохранной терапии. Отклонения от схемы лечения касались редукции доз химиопрепаратов, прерывания лучевой терапии. За время проведения исследования не было ни одной смерти, связанной с токсичностью.Количество поздних осложнений II и III степени тяжести со стороны мочевого пузыря составило 3%, что согласуется с данными литературы. В зависимости от использованных схем органосохраняющей терапии авторы сообщают о развитии лучевых циститов в те же сроки у 0,02 — 25% пациентов.
Источник
Гемзар (Гемцитабин)
Гемзар (Gemzar)
Гемцитабин (Gemcitabine)
2′-Дезокси-2′,2′-дифторцитидин (в виде гидрохлорида)
Фармакологическая группа: Антиметаболиты.
Нозологическая классификация (МКБ-10): C25 Злокачественное новообразование поджелудочной железы. C34 Злокачественное новообразование бронхов и легкого.
Брутто-формула: C9-h21-F2-N3-O4
Код CAS: 95058-81-4
Характеристика: Антиметаболит группы аналогов пиримидина. Белое или не совсем белое вещество, растворимое в воде, умеренно растворимое в метаноле и практически не растворимое в этаноле и полярных органических растворителях. Молекулярная масса 299,66.
В медицинской практике применяется в виде гидрохлорида.
Фармакология: Фармакологическое действие — противоопухолевое. Цитотоксический эффект гемцитабина обусловлен комбинированным действием его активных метаболитов — ди- и трифосфатного нуклеозидов, — образующихся в результате внутриклеточной биотрансформации с участием нуклеозидкиназ.
Гемцитабина дифосфат ингибирует рибонуклеотидредуктазу, катализирующую реакции образования дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК. Гемцитабина трифосфат включается в ДНК, и ее дальнейший синтез прекращается, при этом невозможна репарация ДНК. В Т-лимфобластных клетках гемцитабин индуцирует интернуклеосомальную ДНК-фрагментацию, являющуюся одним из факторов, программирующих гибель клеток.
Обладает фазовой специфичностью действия: останавливает жизнедеятельность клеток в S-фазе и блокирует опухолевую прогрессию клеток в G_1/S-фазе.
Обладает сильным радиосенсибилизирующим действием. В опытах in vitro оказывал значительное радиосенсибилизирующее действие в концентрациях более низких, чем цитотоксические.
В исследованиях с применением тест-систем млекопитающих показано мутагенное действие гемцитабина в in vitro тесте на клетках лимфомы мышей и кластогенный эффект в in vivo микроядерном тесте на мышах. Однако тест Эймса, in vivo тест обмена сестринских хроматид, in vitro тест анализа хромосомных аберраций и in vitro тест внепланового синтеза ДНК были негативны. В исследованиях на мышах показано влияние на фертильность (при внутрибрюшинном введении самцам гемцитабин вызывал снижение сперматогенеза, уменьшение фертильности и снижение частоты имплантации оплодотворенных яйцеклеток, у самок не вызывал нарушения фертильности, но оказывал токсическое действие), эмбриотоксическое и тератогенное действие. В опытах на кроликах вызывал пороки развития плода.
Связывание с белками плазмы незначительное (менее 10%). Объем распределения зависит от продолжительности инфузии (при кратковременном введении — 50 л/м^2, при длительном — 370 л/м^2) и пола. T_1/2 при кратковременной инфузии составляет от 32 до 94 мин, а при продолжительной — 245-638 мин в зависимости от возраста и пола. Т1/2 терминальной фазы активного метаболита (из мононуклеарных клеток периферической крови) 1,7-19,4 ч. Метаболизируется в клетках печени, почек, крови ферментом цитидиндеаминазой поэтапно до образования неактивного матаболита урацила (2′-дезокси-2′, 2′-дифторуридин). С_max этого метаболита достигается через 30 мин после инфузии. Внутриклеточные метаболиты в плазме и моче не выявляются. Экскретируется в виде урацилового метаболита почками (92-98%), менее 1% — с фекалиями; в неизмененном виде почками выводится 1% дозы.
Применение:
— Рак мочевого пузыря.
— Немелкоклеточный рак легкого.
Гемцитабин в монотерапии или в комбинации с цисплатином показан как препарат первой линии для лечения больных местнораспространенным или метастатическим немелкоклеточным раком легкого.
— Рак поджелудочной железы.
Гемцитабин показан для лечения больных местнораспространенной или метастатической аденокарциномой поджелудочной железы.
Гемцитабин в монотерапии или в комбинации с другими противоопухолевыми средствами также проявляет активность при раке молочной железы, при раке яичников, местнораспространенном мелкоклеточном раке легкого и местнораспространенном рефрактерном раке яичка.
Противопоказания: Гиперчувствительность, миелосупрессия, тяжелые нарушения функции печени и почек, вирусные (ветряная оспа, опоясывающий лишай) и другие инфекции, детский возраст (безопасность и эффективность не определены).
Применение при беременности и кормлении грудью: Противопоказано при беременности. На время лечения следует прекратить грудное вскармливание.
Побочные действия:
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): наиболее часто — миелосупрессия (анемия, лейкопения, тромбоцитопения), петехии, гипотензия, менее часто — аритмия, инсульт, гипертензия, инфаркт миокарда, кровотечение (возникало, в основном, у больных раком поджелудочной железы), редко — сердечная недостаточность (отмечалась у больных, леченных по поводу рака легких).
Со стороны респираторной системы: менее часто — бронхоспастические реакции (одышка, затрудненное дыхание, стесненность в грудной клетке и/или стерторозное дыхание), редко — токсическое действие на паренхиму легких или пневмонит (кашель, одышка), отек легких (кашель, затрудненное дыхание).
Со стороны органов ЖКТ: тошнота, рвота (69% случаев), диарея (19%), стоматит (
Со стороны мочеполовой системы: наиболее часто — протеинурия, периферические отеки (пальцев рук, ног или лодыжек), в редких случаях отеки могут носить генерализованный характер, почечная недостаточность, гипербилирубинемия, гематурия, гемолитико-уремический синдром.
Со стороны кожных покровов: более часто — сыпь (30%), алопеция (обычно незначительная), кожные высыпания, кожный зуд.
Прочие: часто (41%) — гриппоподобный синдром (лихорадка, головная боль, боль в спине, озноб, миалгия, слабость, анорексия, катаральные явления, потливость), инфекция (16%), менее часто — парестезия, образование экстравазата (раздражение, боль или покраснение) в месте инъекции, сонливость, редко — болезнь Гассера (черный дегтеобразный стул, кровь в моче или кале, повышенная температура тела, повышенное или сниженное мочевыделение, точечные красные пятна на коже, отечность лица, пальцев рук, ног или лодыжек, необычные кровотечения или кровоизлияния, необычная усталость или слабость, желтушность склер или кожи).
Взаимодействие: Другие препараты, вызывающие угнетение функции костного мозга, и лучевая терапия потенцируют эффект и аддитивно угнетают функцию костного мозга. Азатиоприн, хлорамбуцил, глюкокортикоиды, циклофосфамид, циклоспорин, меркаптурин и другие иммунодепрессивные средства повышают риск инфекции. При введении живых вирусных вакцин возможна интенсификация репликации вакцинного вируса и усиление побочных эффектов, при введении инактивированных вакцин — подавление выработки противовирусных антител.
Передозировка: Симптомы: угнетение функции костного мозга (анемия, лейкопения или нейтропения, возможно, с инфекцией, тромбоцитопения), парестезия (ощущение онемения или покалывания в кистях или стопах), сильно выраженная кожная сыпь.
Лечение: проводят мониторинг числа форменных элементов крови, при необходимости назначают поддерживающую терапию. При сильном угнетении функции костного мозга возможно переливание необходимых компонентов крови. Больных с развившейся лейкопенией наблюдают для выявления признаков инфекции, при необходимости назначают антибиотики. Больным с нейтропенией при повышении температуры тела антибиотики широкого спектра действия назначают эмпирически до получения результатов бактериологических исследований и соответствующих диагностических тестов. Специфический антидот отсутствует.
Способ применения и дозы: В/в, капельно (в течение 30 мин), в дозе 1 г/м2 1 раз в неделю, курс — 3 нед, повторный курс через 1 нед.
Меры предосторожности: Применение гемцитабина следует проводить под строгим контролем показателей крови (1 раз в 2 нед). При уменьшении числа лейкоцитов <1500/мм3 и тромбоцитов <100000/мм3 обязательна коррекция дозы. Показанием для отмены препарата является уменьшение числа лейкоцитов <500/мм3 и тромбоцитов <50000/мм3.
В случае подтверждения или подозрения на пневмонит, вызванный гемцитабином, лечение следует немедленно прекратить.
Женщины детородного возраста должны использовать эффективные методы контрацепции (возможность тератогенного действия).
С осторожностью применяют у людей пожилого возраста (повышен риск токсического действия на кровь), у больных, ранее получавших цитотоксические препараты или лучевую терапию. Следует воздержаться от потенциально опасных видов деятельности, требующих повышенного внимания и быстроты психических и двигательных реакций.
В период лечения не рекомендуется проведение вакцинации вирусными вакцинами. Назначение вирусных вакцин возможно не ранее 3 мес — 1 года после прекращения применения препарата. Иммунизацию пероральной вакциной против полиомиелита людей, находящихся в близком контакте с больным, особенно членов семьи, следует отсрочить.
Появление признаков угнетения костного мозга, необычных кровотечений или кровоизлияний, черного дегтеобразного стула, крови в моче или кале или точечных красных пятен на коже требуют немедленной консультации врача.
Стоматологические вмешательства необходимо завершить до начала терапии или отложить до нормализации картины крови. В ходе лечения соблюдать осторожность при использовании зубных щеток, нитей или зубочисток.
Особые указания: При применении гемцитабина чаще 1 раза в неделю или проведении инфузии в течение более 60 мин неблагоприятные эффекты, связаннные с терапией гемцитабином, могут отмечаться более часто и быть более выраженными.
Предшествующее лечение цитостатиками увеличивает частоту и тяжесть лейкопении и тромбоцитопении (прогрессивное снижение числа лейкоцитов и тромбоцитов может происходить после завершения терапии).
Применение гемцитабина должно проводиться специально обученным медицинским персоналом с соблюдением установленных мер предосторожности при приготовлении, разбавлении инъекционных растворов (в стерильном боксе с использованием одноразовых хирургических перчаток и масок) и уничтожении игл, шприцев, флаконов, ампул и остатка неиспользованного препарата.
При случайном попадании гемцитабина на кожу и слизистые оболочки пораженный участок необходимо немедленно промыть водой с мылом или тщательно сильной струей воды соответственно.
Литература: 1. Гуторов С.Л., Семенова Н.Н., Загрекова Е.И. Новые лекарства в лечении солидных опухолей//РМЖ.- 2001.- Т. 9.- N 22.- С. 1017-1020. 2. Макаренко Н.П. Перспективы химиотерапии рака молочной железы: возможности гемзара по материалам ASCO 2001 г.//Consilium medicum: Современная онкология.- 2001.- Т. 3.- N 3.
Источник