Гемзар при раке мочевого пузыря
Содержание статьи
Гемзар — инструкция по применению
Регистрационный номер:
П N 013405/01-180510
Торговое название препарата: Гемзар
Международное непатентованное название:
гемцитабин (gemcitabine)
Лекарственная форма:
лиофилизат для приготовления раствора для инфузий
Состав
В одном флаконе содержится:
активное вещество: гемцитабина гидрохлорид, эквивалентный 200 мг или 1 г гемцитабина
вспомогательные вещества: маннитол, натрия ацетат
Описание
Лиофилизат от белого до почти белого цвета.
Фармакотерапевтическая группа:
противоопухолевое средство, антиметаболит.
Код АТХ: L01BC05
Фармакологические свойства
Фармакодинамика
Гемцитабин представляет собой антиметаболит группы аналогов пиримидина. Препарат проявляет циклоспецифичность, действуя на клетки в фазах S и G1/S.
Гемцитабин метаболизируется внутри клетки под действием нуклеозидкиназ с образованием активных дифосфатных и трифосфатных нуклеозидов. Дифосфатные нуклеозиды ингибируют рибонуклеотидредуктазу, которая действует в качестве единственного катализатора реакций, приводящих к образованию дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК. Трифосфатные нуклеозиды активно конкурируют с дезоксицитидинтрифосфатом за встраивание в молекулы ДНК и РНК. После встраивания внутриклеточных метаболитов гемцитабина в цепь ДНК, к ее растущим нитям добавляется ещё один дополнительный нуклеотид, что приводит к полному ингибированию дальнейшего синтеза ДНК и запрограммированной гибели клетки, известной как апоптоз.
Фармакокинетика
Гемцитабин быстро выводится из организма с мочой в основном в виде неактивного метаболита 2′-дезокси-2′,2′-дифторуридина. Менее 10% введённой внутривенно дозы обнаруживается в моче в форме неизменённого препарата. Связывание гемцитабина с белками плазмы незначительное.
Фармакокинетический анализ исследований с однократным и многократным введением доз показывает, что объём распределения в значительной степени зависит от пола. Системный клиренс, который колеблется примерно от 30 л/ч/м2 до 90 л/ч/м2, зависит от возраста и пола. Период полувыведения колеблется от 32 минут до 94 минут.
Показания к применению
- Немелкоклеточный рак лёгкого
- Рак молочной железы
- Рак мочевого пузыря
- Рак яичников
- Рак поджелудочной железы
- Рак шейки матки
Гемцитабин в монотерапии или в комбинации с другими противоопухолевыми средствами также проявляет активность при местнораспространенном мелкоклеточном раке легкого, местнораспространенном рефрактерном раке яичка и раке желчевыводящих путей.
Противопоказания
Повышенная чувствительность к гемцитабину или другим компонентам препарата Беременность и период кормления грудью
С осторожностью
При нарушении функции печени и/или почек, угнетении костномозгового кроветворения (в том числе на фоне сопутствующей лучевой или химиотерапии), острых инфекционных заболеваниях вирусной, грибковой или бактериальной природы.
Способ применения и дозы
Гемцитабин вводится внутривенно капельно в течение 30 минут.
Немелкоклеточный рак легкого (местнораспространенный или метастатический).
Монотерапия. Рекомендованная доза препарата — 1000 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла.
Комбинированная терапия. Рекомендованная доза препарата — 1250 мг/м в 1 и 8 день каждого 21-дневного цикла или 1000 мг/м’ в 1, 8 и 15 дни каждого 28-дневного цикла. Цисплатин вводится в дозе 70 мг/м в 1 день цикла после инфузии гемцитабина на фоне гипергидратации.
Рак молочной железы (местнораспространенный или метастатический).
Монотерапия. При прогрессировании заболевания после первой линии терапии, включающей антрациклины при отсутствии противопоказаний к ним. Рекомендованная доза препарата — 1000-1200 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла.
Комбинированная терапия. В качестве терапии первой линии при прогрессировании заболевания после неоадъювантной и/или адъювантной терапии, включающей антрациклины. Рекомендованная доза препарата — 1250 мг/м2 в 1 и 8 дни в сочетании с паклитакселом, который вводится после гемцитабина в дозе 175 мг/м» в I день каждого 21-дневного цикла внутривенно капельно примерно в течение 3 часов.
Рак мочевого пузыря (местнораспространенный, метастатический и поверхностный).
Монотерапия. Рекомендованная доза препарата — 1250 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла.
Комбинированная терапия. Рекомендованная доза препарата — 1000 мг/м2 в 1, 8 и 15 дни в сочетании с цисплатином, который вводится в дозе 70 мг/м2 сразу после инфузии гемцитабина в 1 или во 2 день каждого 28-дневного цикла.
Внутрипузырная химиотерапия. Рекомендованная доза препарата — 2000 мг. Для получения раствора для инстилляций препарат растворяют в 100 или 50 мл 0,9% раствора натрия хлорида : до концентрации от 20 до 40 мг/мл. Экспозиция препарата составляет 60 минут. Вводится один раз в неделю в течение 6 недель. Концентрация раствора не должна превышать 40 мг/мл.
Эпителиальный рак яичников (местнораспространенный или метастатический).
Монотерапия. Рекомендованная доза препарата — 800-1250 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла.
Комбинированная терапия. Рекомендованная доза препарата — 1000 мг/м2 в 1 и 8 дни в сочетании с карбоплатином в дозе AUC 4,0 мг/мл/мин, который вводится сразу после инфузии гемцитабина в 1 день каждого 21-дневного цикла.
Рак поджелудочной железы (местнораспространенный или метастатический).
Монотерапия. Рекомендованная доза препарата — 1000 мг/м2 один раз в неделю в течение 7 недель с последующим недельным перерывом. Затем препарат вводится в 1, 8 и 15 дни каждого 28-дневного цикла.
Рак шейки матки (местнораспространенный или метастатический).
Комбинированная терапия. При местнораспространённом раке при последовательной химиолучевой терапии (неоадъювантно) и при метастатическом раке гемцитабин вводится в дозе 1250 мг/м2 в 1 и 8 дни каждого 21-дневного цикла. Цисплатин вводится после введения гемцитабина в дозе 70 мг/м2 в 1 день цикла на фоне гипергидратации. При местнораспространённом раке при одновременной химиолучевой терапии гемцитабин вводится 1 раз в неделю за 1-2 часа до начала лучевой терапии в дозе 125 мг/м2 с последующим (непосредственно после введения гемцитабина) введением цисплатина в дозе 40 мг/м2.
Перед каждым введением гемцитабина необходимо контролировать количество тромбоцитов, лейкоцитов и гранулоцитов в крови. При признаках угнетения функции костного мозга необходимо приостановить лечение или скорректировать дозу.
В случае развития гематологической токсичности доза гемцитабина может быть уменьшена, либо её введение отложено в соответствии со следующей схемой:
Абсолютное количество гранулоцитов (в 1 мкл) | Количество тромбоцитов (в 1 мкл) | % от предыдущей дозы | |
| > 1000 | и | > 100000 | 100 |
| 500-1000 | или | 50000-100000 | 75 |
| < 500 | или | < 50000 | Отложить введение |
Особые группы пациентов
Пожилые пациенты: доказательств, позволяющих предположить, что у пожилых больных необходимо корректировать дозу, не имеется, хотя клиренс гемцитабина и период полувыведения с возрастом изменяются.
Пациенты с нарушением функции печени и почек: применять гемцитабин у больных с печёночной недостаточностью или с нарушенной функцией почек следует с осторожностью, так как достаточных данных по применению препарата у этой категории пациентов нет. Умеренная или средней тяжести почечная недостаточность (скорость клубочковой фильтрации от 30 мл/мин до 80 мл/мин) не оказывает заметного влияния на фармакокинетику гемцитабина. Дети: применение гемцитабина у детей не изучалось.
Рекомендации по приготовлению раствора для инфузий
В качестве растворителя используется только 0,9 % раствор натрия хлорида (без консервантов). Для приготовления раствора для инфузий содержимое флакона 200 мг растворяют в не менее, чем 5 мл, и 1 г — в не менее, чем 25 мл 0,9% раствора натрия хлорида для инъекций. Каждый флакон аккуратно взбалтывают до полного растворения лиофилизата. Полученный раствор должен быть прозрачным.
Максимальная концентрация гемцитабина не должна превышать 40 мг/мл. Растворы, приготовленные с концентрацией выше, чем 40 мг/мл, могут сопровождаться неполным растворением.
Приготовленный раствор гемцитабина, содержащий нужную дозу препарата, перед введением разбавляют 0,9% раствором натрия хлорида для инъекций в количестве, достаточном для проведения 30-минутной внутривенной инфузий.
Перед парентеральным введением необходимо визуально контролировать приготовленный раствор на наличие механических примесей и изменение цвета.
Побочное действие
Побочные реакции, встречавшиеся чаще, чем в единичных случаях, перечислены соответствии со следующей градацией: очень часто (> 10%); часто (> 1%, 0,1%, 0,01%,
Со стороны органов кроветворения: часто — лейкопения, тромбоцитопения, анемия; очень редко — тромбоцитоз.
Со стороны системы пищеварения: очень часто — тошнота, рвота, повышение уровня печеночных трансаминаз, щелочной фосфатазы; часто — анорексия, диарея, запор, стоматит, повышение уровня билирубина.
Со стороны мочеполовой системы: очень часто — легкая протеинурия и гематурия; редко — почечная недостаточность, клинические признаки и симптомы, схожие с гемолитико- уремическим синдромом (снижение уровня гемоглобина, тромбоцитопения, увеличение уровней билирубина, креатинина, мочевины и/или лактатдегидрогеназы в сыворотке крови).
Со стороны кожи и кожных придатков: часто — кожные высыпания, кожный зуд, алопеция.
Со стираны дыхательной системы: очень часто одышка, часто — кашель, ринит: иногда — бронхоспазм, интерстициальная пневмония, отек легкого; редко — острый респираторный дистресс-синдром.
Со стороны сердечно-сосудистой системы: редко — снижение артериального давления, инфаркт миокарда, сердечная недостаточность, аритмия.
Со стороны нервной системы: часто — головная боль, сонливость, бессонница.
Прочие: очень часто — гриппоподобный синдром, периферические отеки; часто — повышение температуры тела, озноб, астения, боли в спине, миалгия; иногда — отечность лица; очень редко — анафилактические реакции.
Передозировка
Антидот для гемцитабина не известен. Клинически допустимая токсичность наблюдалась при введении однократных доз вплоть до 5,7 г/м2 внутривенно в течение 30 минут каждые две недели. В случае подозрения на передозировку, больной должен находится под постоянным врачебным контролем, включая подсчет формулы крови. При необходимости больному проводят симптоматическое лечение.
Взаимодействие с другими видами терапии
Гемцитабин обладает радиосенсибилизирующим действием, в связи с чем при применении данного препарата на фоне проведения лучевой терапии можно ожидать усиления лучевых реакций. В случае последовательной химиолучевой терапии гемцитабин можно начинать вводить после разрешения острых лучевых реакций или не менее чем через одну неделю после окончания лучевой терапии.
Особые указания
Лечение гемцитабином можно проводить только под наблюдением врача, имеющего опыт применения противоопухолевой химиотерапии.
Перед началом лечения абсолютное количество гранулоцитов должно быть не менее 1500/мкл, тромбоцитов — не менее 100000/мкл.
Для выявления негематологической токсичности необходимо проводить регулярное обследование больного и оценку функции печени и почек. В зависимости от степени токсичности дозу можно снижать в ходе каждого цикла или с началом нового цикла ступенчато.
Решение об отсрочке очередного введения препарата должно базироваться на клинической оценке врачом динамики токсичности.
Увеличение длительности инфузии и частоты введений приводит к возрастанию токсичности. Введение гемцитабина при метастазах в печени, при гепатите и алкоголизме в анамнезе, а также при циррозе печени увеличивает риск развития печёночной недостаточности. При возникновении первых признаков гемолитико-уремического синдрома лечение гемцитабином следует прекратить.
У больных раком легкого или с метастазами в легких повышен риск возникновения побочных эффектов со стороны системы дыхания.
При появлении первых признаков пневмонита или появлении инфильтратов в легких лечение гемцитабином следует прекратить.
Женщинам и мужчинам во время лечения гемцитабином и, как минимум, в течение 6 месяцев после терапии следует использовать надежные способы контрацепции.
Форма выпуска
Лиофилизат для приготовления раствора для инфузий по 200 мг или 1 г во флаконах из стекла типа I. По одному флакону с инструкцией по применению в картонной пачке.
Условия хранения
Список Б. При температуре 15-30°С в местах, недоступных для детей. Не охлаждать и не замораживать.
Приготовленный раствор: при температуре 15-30°С не более 24 часов, не охлаждать и не замораживать.
Срок годности
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту.
Название и адрес производителя
200 мг:
«Лилли Франс С.А.С.», Франция
Ру ду Колонел Лилли, 67640 Фегершейм,
Франция
«Lilly France S.A.S.», France
Rue du Colonel Lilly, 67640 Fegersheim,
France
1 г:
1) «Лилли Франс C.A.C.», Франция Ру ду Колонел Лилли, 67640 Фегершейм, Франция
«Lilly France S.A.S.», France -Rue»duC6lonirLill^
2) Вайанекс С.А., Греция
Vianex S.A., Greece, 15 km Marathon Avenue,
Pallini Attiki, Athens, Greece
Вайанекс С.А., Греция, 15 км Маратон авеню, Паллини Аттики, Афины, Греция 2. «Вайанекс С.А.», Греция
15 км Маратон авеню, Паллини Аттики, Афины, Греция
«Vianex S.A.», Greece
15 km Marathon Avenue, Pallini Attiki, Athens, Greece
Упаковано:
200 мг:
«Лилли Франс С.А.С.», Франция
Ру ду Колонел Лилли, 67640 Фегершейм, Франция
«Lilly France S.A.S.», France
Rue du Colonel Lilly, 67640 Fegersheim, France
1 г:
1. «Лилли Франс С.А.С.», Франция
Ру ду Колонел Лилли, 67640 Фегершейм, Франция
«Lilly France S.A.S.», France
Rue du Colonel Lilly, 67640 Fegersheim, France
2. «Вайанекс С.А.», Греция
15 км Маратон авеню, Паллини Аттики, Афины, Греция
«Vianex S.A.», Greece
15 km Marathon Avenue, Pallini Attiki, Athens, Greece
Представительство в России
Московское представительство
АО «Эли Лилли Восток С.А.», Швейцария
123317, Москва, Пресненская наб., д. 10
Источник
Органосохраняющее лечение инвазивного рака мочевого пузыря
Лечение инвазивного рака мочевого пузыря — актуальная проблема онкоурологии. Стандартным видом лечения в этой ситуации остается радикальная цистэктомия с различными методами деривации мочи. Вместе с тем существует множество публикаций о возможности проведения органосохраняющее лечения, результаты которого в определенных группах пациентов не уступают таковым после удаления органа. Сочетание эндоскопической хирургии, химио-, лучевой терапии позволяет не только добиться высоких показателей отдаленной выживаемости, но и сохранить собственный функционирующий мочевой пузырь.
Появление в клинической практике химиопрепаратов (гемцитабин, таксаны) высокоэффективных в отношении переходно-клеточного рака, дает надежду на повышение эффективности комбинированного лечения больных инвазивным раком мочевого пузыря.
В исследование было включено 69 больных раком мочевого пузыря в стадии Т2а-4аN0M0. Среди них было 59 мужчин и 10 женщин, средний возраст больных — 59 лет. Характеристика больных представлена в табл. 1.
Таблица 1. Характеристика больных
Показатель | ТУР +2 курса ПХТ+ химиолучевая терапия | 3 курса ПХТ + химиолучевая терапия | Всего |
Количество больных, м./ж. | 31 26/5 | 38 33/5 | 69 59/10 |
Средний возраст, годы | 60 | 58 | 59 |
Стадия: | |||
Т2а | 13 | 6 | 19 |
Т2в | 9 | 6 | 15 |
Т3а | 6 | 19 | 25 |
Т3в | 2 | 5 | 7 |
Т4а | 1 | 2 | 3 |
Функция почек: | |||
сохранена | 25 | 27 | 52 |
нарушена | 6 | 11 | 17 |
Степень дифференцировки: | |||
G1 | 6 | 7 | 13 |
G2 | 14 | 19 | 33 |
G3-4 | 11 | 12 | 23 |
Примечание: ТУР — трансуретральная резекция, ПХТ — полихимиотерапия.
В зависимости от местного распространения опухоли больные распределись следующим образом: у 34 (49%) пациентов заболевание было ограничено стенкой мочевого пузыря (Т2а-2в), у 25 (36%) имелась микроинвазия паравезикальной клетчатки (Т3а) и у 10 (15%) — макроскопическое прорастание стенки органа (Т3в) или инвазия предстательной железы (Т4а). Нарушение оттока мочи, связанное со сдавлением одного из устьев мочеточника опухолью, было у 17 (25%) пациентов. После установления диагноза и перед началом специфического лечения 10 (15%) из них выполнена чрескожная пункционная нефростомия под ультразвуковым контролем. У 2 больных выявлена гидронефротическая трансформация с одной стороны. У 5 больных имелась умеренная пиелоэктазия, которая нормализовалась после начала противоопухолевого лечения.
Во всех случаях гистологически верифицирован переходно-клеточный рак. Высокодифференцированные опухоли (G1) были лишь у 13 (19%) больных, в остальных случаях новообразования состояли из умеренно-, низко- и недифференцированных клеток (G2-4).
Исследование носило пилотный характер. Изучали эффективность органосохраняющей терапии. Применяли два варианта лечения. Первый вариант заключался в последовательном выполнении ТУР экзофитной части опухоли, проведении 2 курсов ПХТ и последующей химиолучевой терапии. Показанием для назначения этого метода органосохранной терапии являлось наличие солитарной опухоли, размером не более 5 см, располагающейся в пределах органа, или с наличием микроинвазии окружающей клетчатки (предстательной железы). Схема лечения представлена на рис. 1.
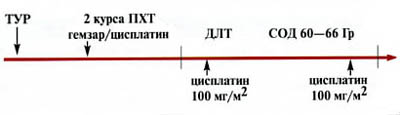
Рис. 1. Схема комбинированного лечения (ТУР, 2 курса химиотерапии, сочетанная химиолучевая терапия) инвазивного рака мочевого пузыря
Целью ТУР было максимальное удаление части новообразования, растущей в просвет органа. Резекция опухоли проводилась последовательно в два этапа. На первом этапе резецировалась экзофитная часть образования, на втором — основание опухоли. После получения гистологического подтверждения мышечной инвазии опухоли больным проводилось два курса системной химиотерапии по схеме гемзар/цисплатин (гемзар — 1000 мг/м2 в 1,8,15-й день, цисплатин — 70 мг/м2 во 2-й день, рецикл — на 29-й день). Для консолидации достигнутого эффекта больным назначалась химиолучевая терапия. Дистанционная лучевая терапия проводилась на ускорителе фирмы «Philips» SL-20 или «Siemens» SL-75 методом дневного дробления дозы на область мочевого пузыря. Дневная доза подводилась дважды по 1 Гр, 5 дней в неделю до суммарной очаговой дозы 60-66 Гр. Размер поля 8х10 или 10х10см. Расстояние «источник — центр ротации» — 100 см. В первую и последнюю 5-дневку проведения лучевой терапии дважды внутривенно вводился цисплатин в дозе 100 мг/м2, сенсибилизирующий опухоль к действию ионизирующего излучения.
Другой вариант комбинированного лечения применялся у больных с опухолями > 5 см либо с мультифокальным поражением мочевого пузыря. Лечение состояло из ряда последовательных этапов (рис. 2).
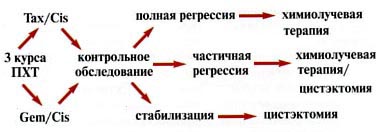
Рис. 2. Схема комбинированного лечения (3 курса химиотерапии + сочетанная химиолучевая терапия) инвазивного рака мочевого пузыря. Tax/Cis — таксотер/цисплатин, Gem/Cis — гемзар/цисплатин
Первоначально всем пациентам назначалось три курса системной ПХТ. Применялись схемы: гемзар/цисплатин и таксотер/цисплатин (таксотер — 75 мг/м2 в 1-й день, цисплатин — 75 мг/м2 в 1-й день, рецикл на 22-й день). Цель неоадъювантной химиотерапии — уменьшение объема опухоли и воздействие на возможные микрометастазы, не определяемые лучевыми методами диагностики. Через 3-4 нед после завершения химиотерапии больных госпитализировали для обследования и продолжения лечения. В случае полной регрессии (ПР) заболевания, проводилась дистанционная лучевая терапия с сочетанным введением цисплатина по той же методике, что и в предыдущей группе. Консервативное лечение также могло быть назначено больным, у которых по данным УЗИ, компьютерной томографии (КТ) и цистоскопии не визуализировалось опухолевых образований, но биопсия из ложа опухоли выявляла микроочаги переходно-клеточного рака. Таким образом, микроскопическое наличие опухоли после неоадъювантной химиотерапии не являлось противопоказанием к проведению консервативного лечения. Решение о продолжении органосохраняющей терапии принималось совместно с пациентом, после обсуждения возможных вариантов лечения и прогноза. При наличии макроскопически определяемых остаточных образований больным рекомендовалось удаление мочевого пузыря.
Непосредственные результаты лечения оценивались через 3 и 6 мес. после его окончания. Для определения объективной регрессии опухоли обязательным являлись пальцевое ректальное исследование, УЗИ, КТ малого таза, цистоскопия с биопсией. Все пациенты, у которых достигнута ПР опухоли через 3 мес после завершения органосохраняющей лечения, оставались под наблюдением. Выявление остаточной опухоли являлось показанием к продолжению лечения. В случае одиночного поверхностного резидуального образования больным выполнялась ТУР с последующей химиотерапией. Если имелась остаточная опухоль без четких границ с признаками инвазивного роста, пациентам предлагалась «спасительная» цистэктомия. Однако при наличии противопоказаний к операции или отказе от удаления мочевого пузыря больным назначалась системная химиотерапия.
Выраженность побочных эффектов в процессе органосохраняющей лечения оценивали по общим критериям токсичности, разработанным Национальным институтом рака США (Common Toxicity Criteria, version 2.0). После окончания терапии больные оставались под наблюдением. Контрольные осмотры проводились через каждые 3 мес в течение первых 2 лет, через 6 мес на 3-м году и затем ежегодно. При наличии остаточной опухоли, рецидива или при прогрессировании болезни этот график изменяли в зависимости от клинической ситуации. Помимо оценки проявлений основного заболевания, во время контрольных осмотров анализировали поздние лучевые реакции. Побочные реакции оценивали по шкале поздних лучевых осложнений, разработанной радиотерапевтической онкологической группой и Европейской организацией по исследованию и лечению рака (RTOG/EORTC Late Radiation Morbidity Scoring Scheme).
Из 69 больных, включенных в исследование, органосохраняющие лечение проведено 64 (92,7%). В их число вошли все пациенты (n=31) 1-й группы, которым проведена комбинированная терапия — ТУР, 2 курса ПХТ гемзар/цисплатин и химиолучевая терапия, а также 33 больных 2-й группы (n=38), в которой применялась комбинация — 3 курса ПХТ + химиолучевая терапия/цистэктомия. 5 больным — после неоадъювантного лечения выполнена радикальная цистэктомия. В табл. 2 представлены результаты 3 курсов системной химиотерапии.
Таблица 2. Регрессия опухоли после неоадъювантной химиотерапии
Схема химиотерапии | Количество больных | ПР | ЧР | Стаби-ли-зация |
Гемзар/ Цисплатин | 20 | 5 | 13 | 2 |
Таксотер/ Цисплатин | 18 | 6 | 12 | — |
Органосохраняющее лечение проведено 11 больным с ПР и 23 пациентам — с частичной регрессией (ЧР) опухоли. Результаты органосохранной терапии, зарегистрированные через 3 и 6 мес после ее окончания, представлены в табл. 3.
Таблица 3. Результаты органосохраняющей терапии
Схема лечения | Количество больных | Результаты лечения, % | |||
через 3 мес | через 6 мес | ||||
ПР | ЧР | ПР | ЧР | ||
ТУР + 2 курса ПХТ+ химиолучевая терапия | 31 | 21 | 10 | 26 | 5 |
3 курса ПХТ + химиолучевая терапия | 38 * | 19 | 14 | 23 | 10 |
* — 5 из этих больных выполнена радикальная цистэктомия.
Количество ПР через 6 мес после завершения лечения возросло, что, вероятно, связано с продолжающейся гибелью опухолевых клеток после химиолучевой терапии, а также с проведением адъювантной терапии. У всех пациентов с ПР после неоадъювантной химиотерапии подтверждено отсутствие опухолевого роста после завершения химиолучевого лечения. Следует отметить удовлетворительную переносимость органосохраняющего лечения. Клинически значимые побочные эффекты суммированы в табл. 4.
Таблица 4. Побочные реакции комбинированного лечения
Токсичность (CTC, version 2.0) | Степень | ТУР + 2 курса ПХТ + химио-лучевая терапия | 3 курса ПХТ + химио-лучевая терапия |
Нейтропения | II-IV | 9 (29) | 11 (29) |
Тромбоци-топения | II-III | 6 (19,4) | 4 (10,5) |
Дизурия | II-III | 1 (3,2) | 2 (6) |
Учащенное мочеиспус-кание | II-III | 1 (3,2) | — |
Примечание: В скобках — процент больных.
Все побочные реакции относительно легко устранялись соответствующим лечением или изменением плана комбинированной терапии.
Редукция доз химиопрепаратов в процессе неоадъювантного лечения потребовалась 24 (34,8%) больным. Дистанционная лучевая терапия доведена до радикальной дозы 60-66 Гр у 60 (93,7%) пациентов. У 4 (6,3%) больных облучение прекращено на СОД 22; 56; 58 и 58 Гр соответственно в связи с развитием острых лучевых реакций III степени тяжести со стороны нижних мочевыводящих путей (дизурия, учащенное мочеиспускание). 46 (71,8%) больным в процессе лучевой терапии дважды вводился цисплатин в дозе 100мг/м2. У 2 пациентов доза редуцирована на 50% в связи с хронической почечной недостаточностью. 16 (25%) пациентам радиосенсибилизация не проводилась, причинами этого были: единственная функционирующая почка (2 больных), печеночная токсичность на неоадъювантном этапе (1), выраженная сердечно-сосудистая патология, лучевая терапия по месту жительства.
Длительность наблюдения в группах больных составила в среднем 34 и 30,2 мес соответственно. Показатели 3-летней общей и скорректированной выживаемости в 1-й группе совпали и были равны 83,3%; во 2-й группе они составили 61,7 и 73,4%.За время наблюдения ни у одного больного не произошло сморщивания мочевого пузыря. Лишь у 2 (3%) пациентов отмечены поздние лучевые циститы II и III степени тяжести.
Мы оценивали также влияние местного распространения опухоли, гистологической дифференцировки опухолевых клеток, наличия пиелоэктазии в связи с опухолью, степени регрессии заболевания на выживаемость больных после органосохраняющей терапии. С этой целью мы объединили обе группы пациентов и сформированы две новые группы. В 1-ю группу вошли больные, у которых опухоль ограничена стенкой мочевого пузыря (Т2а-Т2б), во 2-ю — с распространением опухоли за пределы органа (Т3а-Т4а). По данным однофакторного анализа, влияние на выживаемость имеют стадия Т опухоли и степень ее регрессии после окончания органосохраняющего лечения (табл. 5).
Таблица 5. Влияние факторов прогноза на выживаемость
Критерий прогноза | 3-летняя выжива-емость, % | Однофак-торный анализ (log-rank test) | Много-фак-торный анализ (Cox) | |
Стадия | Т2а-Т2б | 90 | р = 0,02 | р = 0,037 |
Т3а-Т4а | 66 | |||
Степень дифферен-цировки | G1 | 90 | p= 0,921 | p= 0,884 |
G2 | 69 | |||
G3-4 | 84 | |||
Функция почек | Сохранена | 86 | р= 0,067 | р= 0,09 |
Нарушена | 60 | |||
Степень регрессии | ПР | 100 | р=0,001 | р= 0,001 |
ЧР | 45 | |||
Как показал статистический анализ, достоверными критериями (p < 0,05), влияющими на отдаленные результаты лечения, являются: стадии Т2а-Т2бN0M0; ПР опухоли, зарегистрированная через 3 мес после органосохраняющей терапии. Также выявлена тенденция (p < 0,1) к повышению выживаемости больных с сохраненной почечной функцией. Статистически значимого влияния степени дифференцировки опухолевых клеток на эффективность лечения не получено.Эффективность органосохраняющей терапии, продемонстрированная в данном исследовании, в очередной раз подчеркивает правомочность такого подхода. Очевидно, что невозможно проводить прямые сравнения представленных результатов комбинированного лечения с выживаемостью больных после удаления мочевого пузыря. Однако полученные показатели 3-летней выживаемости вполне сопоставимы с эффективностью радикального лечения. Всегда есть пациенты, у которых невозможно сохранить мочевой пузырь и приходится выполнять радикальную цистэктомию. Но определенной группе больных с инвазивным раком мочевого пузыря уже сейчас можно проводить органосохраняющее лечение с положительным результатом.
Разработанное органосохраняющее лечение сопровождалось побочными реакциями, типичными для использованных схем химиотерапии (гемзар/цисплатин, таксотер/цисплатин) и сочетанного химиолучевого воздействия на область мочевого пузыря. Во всех случаях побочные эффекты контролировались своевременным назначением корригирующего лечения или изменением плана органосохранной терапии. Отклонения от схемы лечения касались редукции доз химиопрепаратов, прерывания лучевой терапии. За время проведения исследования не было ни одной смерти, связанной с токсичностью.Количество поздних осложнений II и III степени тяжести со стороны мочевого пузыря составило 3%, что согласуется с данными литературы. В зависимости от использованных схем органосохраняющей терапии авторы сообщают о развитии лучевых циститов в те же сроки у 0,02 — 25% пациентов.
Источник