Что такое денатурация белка что может явиться причиной денатурации
Содержание статьи
Что такое денатурация белка :: SYL.ru
Денатурация белка — это процесс, который связан с нарушением вторичной, третичной, четвертичной структур молекулы под воздействием разных факторов.
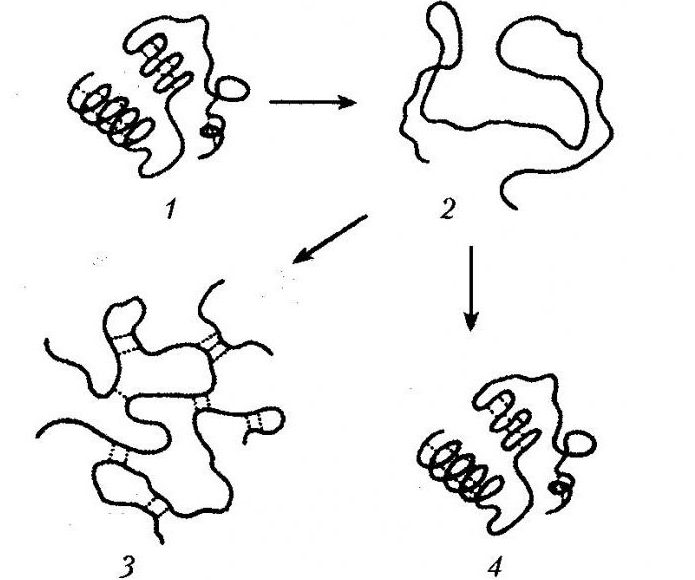
Особенности процесса
Он сопровождается разворачиванием полипептидной связи, которая в растворе изначально представлена в виде беспорядочного клубка.
Процесс денатурации белка сопровождается утрачиванием гидратной оболочки, выпадением белка в осадок, утрачиванием им нативных свойств.
Среди основных факторов, которые провоцируют процесс денатурации, выделим физические параметры: давление, температуру, механическое действие, ионизирующее и ультразвуковое излучение.
Денатурация белка происходит под воздействием органических растворителей, минеральных кислот, щелочей, солей тяжелых металлов, алкалоидов.

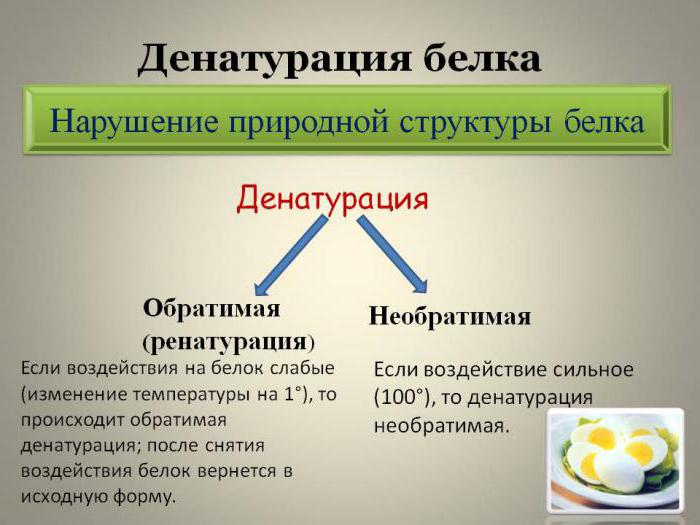
Виды
В биологии выделяют два варианта денатурации:
- Обратимая денатурация белка (ренатурация) предполагает процесс, в котором денатурированный белок после устранения всех денатурирующих веществ восстанавливается в исходную структуру. В этом случае в полном объеме возвращается биологическая активность.
- Необратимая денатурация предполагает полное разрушение молекулы, даже после удаления из раствора денатурирующих реагентов физиологичная активность не возвращается.
Особенности денатурированных белков
После того как произошла денатурация белка, он получает определенные свойства:
- В сравнении с нативной белковой молекулой увеличивается количество функциональных либо реактивных групп в молекуле.
- Уменьшается растворимость и процесс осаждения белков, чему способствует потеря водной оболочки. Происходит разворачивание структуры, появляются гидрофобные радикалы, наблюдается нейтрализация зарядов полярных фрагментов.
- Меняется конфигурация белковой молекулы.
- Утрачивается биологическая активность, причиной этого будет нарушение нативной структуры.
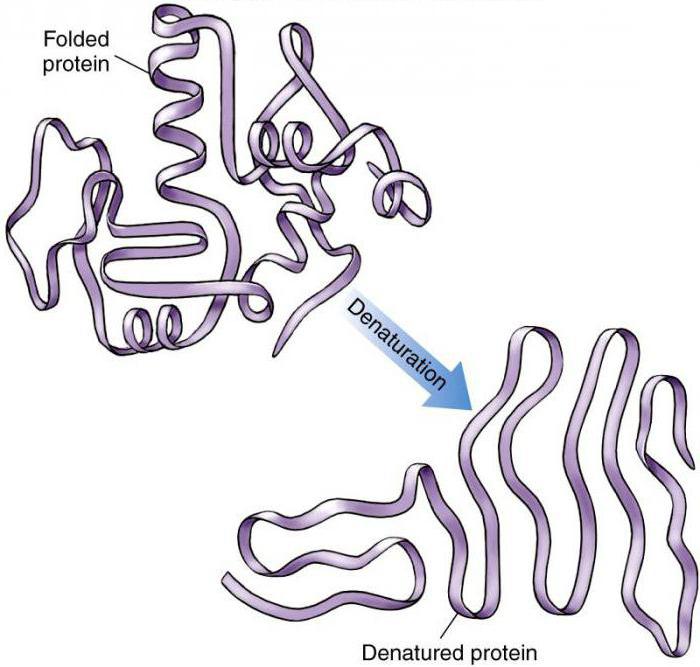
Последствия
После денатурации происходит переход нативной компактной структуры в рыхлую развернутую форму, упрощается проникновение к пептидным связям ферментов, необходимых для разрушения.
Конформация белковых молекул определяется возникновением достаточного количества связей между разными участками определенной полипептидной цепочки.
Белки, состоящие из достаточного количества атомов, которые находятся в непрерывном хаотичном движении, способствует определенным перемещениям частей полипептидной цепи, что вызывает нарушение общей структуры белков, снижение его физиологических функций.
Белки имеют конформационную лабильность, то есть предрасположенность к незначительным изменениям конформации, происходящим в результате обрыва одних и образования других связей.
Денатурация белка приводит к изменениям его химических свойств, способности вступать во взаимодействие с другими веществами. Наблюдается изменение пространственной структуры и участка, непосредственно контактирующего с иной молекулой, и всей конформацией в целом. Наблюдаемые конформационные изменения имеют значение для функционирования белков в живой клетке.
Механизм разрушения
Процесс денатурации белка предполагает разрушение химических (водородных, дисульфидных, электростатических) связей, стабилизирующих высшие уровни организации молекулы белка. В результате этого меняется пространственная структура белка. Во многих ситуациях не наблюдается разрушения его первичной структуры. Это дает возможность после раскручивания полипептидной цепи стихийно скручиваться протеину, создавая «случайный клубок». В подобной ситуации наблюдается переход к беспорядочному состоянию, имеющему существенные отличия от нативной конформации.
Заключение
Температура денатурации белков превышает 56 градусов Цельсия. Типичными признаками прохождения необратимой денатурации белковых молекул считаются снижение растворимости и гидрофильности молекул, повышение оптической активности, понижение стойкости белковых растворов, увеличение вязкости.
Денатурация вызывает агрегацию частиц, они могут выпадать в осадок. Если на белок действует денатурирующий агент на протяжении незначительного временного промежутка, высока вероятность восстановления нативной белковой структуры. Данные процессы широко используют при переработке продуктов питания, консервировании, изготовлении обуви, одежды, во время сушки фруктов и овощей. Денатурацию используют в ветеринарии, медицине, клинике, фармации, при проведении биохимических исследований, связанных с осаждением в биологическом материале протеина. Далее проводится идентификация в исследуемом растворе небелковых и низкомолекулярных инстанций, в результате чего можно установить количественное содержание веществ. В настоящее время ищут способы защиты белковых молекул от разрушения.
Источник
ДЕНАТУРАЦИЯ — Большая Медицинская Энциклопедия
ДЕНАТУРАЦИЯ — существенные изменения природных свойств вещества под влиянием химических или физических воздействий. Термин «денатурация» применяется обычно к белкам (см.). Нарушение нативной уникальной структуры под влиянием повышения температуры, высокого гидростатического давления, ультразвука, ионизирующих излучений, резких сдвигов pH, добавления некоторых химических веществ, разрывающих нековалентные связи (напр., мочевины, солей гуанидина, трифторуксусной или трихлоруксусной к-т), называется общим термином «денатурация белков». Молекуле нативного белка свойственна внутренняя упорядоченность, поддерживаемая системой нековалентных связей между многочисленными структурными элементами. При Денатурации такая упорядоченность нарушается. Ковалентные (химические) связи в молекуле белка при Денатурации не затрагиваются, и первичная структура белка сохраняется. Структуры высоких порядков — вторичная или третичная — нарушаются полностью или в значительной степени. Изменение нативного состояния молекул, аналогичное Денатурации белков, известно также и для нуклеиновых кислот (см.).
Биологически активные белки — ферменты, антитела и др.— при Д. инактивируются. Причиной этого является то, что в процессе Д. нарушаются активные центры — точно организованные участки белковых молекул, непосредственно ответственные за соответствующую биол, функцию. Физ.-хим. изменения, сопровождающие Д., также связаны с нарушением упорядоченной структуры белка. Так, при Д. нарушаются (в различной степени) спирализованные участки полипептидной цепи, что фиксируется соответствующими спектрополяриметрическими сдвигами. Переход полипептидной цепи белка из плотно упакованного в беспорядочное и подвижное состояние вызывает изменение вязкости и других гидродинамических свойств их р-ров. В состоянии Д., когда полипептидная цепь становится более подвижной, общая реактивность хим. групп увеличивается. Нетитрующиеся (т. е. не вступающие в реакцию) сульфгидрильные (SH-) и некоторые другие группы, присутствующие во многих нативных белках, обычно титруются после Д. Взаимодействие белков с нек-рыми красителями резко усиливается в результате Д. Из-за повышения доступности и увеличения реактивности различных хим. групп при Д. очень сильно возрастает степень взаимодействия между отдельными белковыми молекулами. В денатурированном состоянии белки легко агрегируют, т. е. денатурированные белки легко осаждаются, свертываются или же латинизируются. Для сохранения белка в растворенном состоянии после Д. приходится применять солюбилизирующие вещества — детергенты (см.), мочевину и др.
Д. белков обычно сопровождается значительным увеличением теплосодержания и энтропии (см. Термодинамика), хотя эти изменения зависят от условий среды. В простейших случаях система при Д., по-видимому, содержит всего две формы белка — нативную и полностью денатурированную. По мере Д. белок переходит из одной формы в другую без заметного образования каких-либо промежуточных форм и, следовательно, весь денатурационный переход белковой молекулы протекает как единый скачок. В других случаях кинетика денатурации указывает на образование в ходе реакции нескольких относительно стабильных не нативных форм белка, что соответствует более сложной схеме перехода. Но если при Д. молекула белка претерпевает несколько конформационных превращений, то каждое из них является кооперативным, т. е. включает большое число взаимозависимых реакций, заключающихся в образовании и разрыве нековалентных связей.
В прошлом Д. рассматривали как необратимый процесс, как переход белка в состояние, имеющее минимальный уровень свободной энергии. Теперь хорошо известно, что Д. обратима. Фактически наступающая необратимость создается, как оказалось, сопутствующими реакциями — агрегацией белка, окислением SH-групп с образованием новых дисульфидных (S—S) связей и пр. Если эти реакции в достаточной мере исключены, то тенденция к возвращению белка в нативное состояние (ренатурация) проявляет себя сразу же по прекращении действия денатурирующего агента.
Если Д. по существу представляет собой физ. переход упорядоченность — беспорядок, то в ренатурации ярко проявляется биол, особенность белков — способность к самоорганизации, путь к-рой определен строением полипептидной цепи, т. е. наследственной информацией. В условиях живой клетки данная информация, вероятно, является решающей для преобразования беспорядочной полипептидной цепи во время или после ее биосинтеза на рибосоме в нативную молекулу белка.
Библиография: Белицер В. А. Макроструктура и денатурационные превращения белков, Укр. биохим, журн., т. 24, в. 2, с. 290, 1962, библиогр.;
Жоли М. Физическая химия денатурации белков, пер. с англ., М., 1968, библиогр.;
Птицын О. Б. Физические принципы самоорганизации белковых цепей, Усп. совр, биол., т. 69, в. 1, с. 26, 1970, библиогр.; Anfinsen С. В. The formation and stabilization of protein structure, Biochem. J., v. 128, p. 737, 1972, bibliogr.; Anfinsen G. B. a. Scheraga H. A. Experimental and theoretical aspects of protein folding, Advanc. Protein Chem., v. 29, p. 205, 1975, bibliogr.; Morawetz H. Rate of conformational transitions in biological macromolecules and their analogs, ibid., v. 26, p. 243, 1972, bibliogr.
В. А. Белицер.
Источник: Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание
Рекомендуемые статьи
Источник
Денатурация белков. Что же это такое? — FoodInside
Белок – жизненно необходимый продукт для человека. Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Животные и растительные белки существенно различаются по аминокислотному составу и уровню биологической ценности. Аминокислотный состав мышечных и молочных белков близок к составу белков человека; большая часть белков животного происхождения является полноценной, тогда как растительные — из-за относительно низкого содержания в них лизина, триптофана, треонина и других незаменимых аминокислот – неполноценны.
Пищевая ценность животных белков идентична ценности белков мяса, они имеют приблизительно такой же состав и сбалансированность аминокислот. Благодаря химическому составу и функциональным свойствам, животные белки являются альтернативой и могут использоваться при производстве мясных продуктов с целью полноценной замены мяса, повышения пищевой и биологической ценности.

Полноценность белка
Для нормальной жизнедеятельности взрослого человека количество незаменимых аминокислот в суточном белковом рационе должно составлять 36-40%, что обеспечивается при соотношении животных белков к растительным, равном 55:45. При этом, годовая потребность в полноценном белке составляет от 20 до 26 кг.
К основным незаменимым аминокислотам относят валин, лейцин, изолейцин, триптофан, метионин, лизин, фенилаланин и треонин. Тирозин, цистеин, аргинин и гистидин — считают условно незаменимыми (или частично заменимыми), так как в организме они синтезируются довольно медленно. Установлено, что дефицит незаменимых аминокислот в питании может приводить к весьма тяжелым последствиям.
По степени соответствия количественного содержания отдельных незаменимых аминокислот (НАК) в составе белкового компонента продукта их содержанию в эталонном белке судят о его биологической ценности, определяя так называемый аминокислотный скор (АКС).

Аминокислотный состав эталонных белков определен в результате многолетних медико-биологических исследований, сбалансирован с учетом потребностей конкретного контингента в каждой НАК, в связи с чем иногда эталонный белок называют «идеальным».
Аминокислотный скор выражают в процентах или в виде безразмерной величины, представляющих собой отношение содержания каждой НАК в исследуемом белке к ее количеству в эталонном белке. Аминокислоты, скор которых составляет менее 100% (либо 1.0), считают лимитирующими. НАК, скор которой имеет самое низкое значение, называется первой лимитирующей аминокислотой. Значение скора именно этой аминокислоты предопределяет биологическую ценность и степень усвоения белков.
Таким образом, показатель аминокислотного скора устанавливает предельно возможный уровень использования азота данного вида белка для пластических целей. Избыток других имеющихся в составе белка аминокислот будет использоваться как источник неспецифического азота либо для энергетических потребностей организма.
При этом следует отметить, что с позиций рационального питания доля энергии, выделяющейся при биологическом окислении белка в организме не должна превышать 10% от общей калорийности суточного рациона.

Денатурация белков
Природные белковые тела наделены определенной, строго заданной пространственной конфигурацией и обладают рядом характерных физико-химических и биологических свойств при физиологических значениях температуры и рН среды. Под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства.
Денатурация белков (от лат.de- — приставка, означающая отделение, удаление и лат. nature — природа; не путать с лат. denaturatus — лишенный природных свойств) — потеря белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.

Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов.
При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка. При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства.
Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.

Необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов. Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы (к примеру жаренное яйцо).
Источник
Денатурация белка
Нативная конформация белковых молекул не является жесткой, она довольно лабильна (от лат. labilis — скользящий) и при ряде воздействий может серьезно нарушаться. Денатурацией (от лат. denaturare — лишать природных свойств) белка называется такое нарушение его нативной конформации, которое сопровождается изменением его нативных свойств, но не разрывом пептидных связей.
Таким образом, денатурация белка может быть вызвана различными относительно мягкими воздействиями, приводящими к нарушению в его молекулах слабых взаимодействий — водородных, ионных связей и гидрофобных контактов, а также к разрыву ди- сульфидных связей, стабилизирующих нативную структуру белка. При этом нарушаются вторичная, третичная и четвертичная структуры белковых молекул, но не нарушаются ковалентные связи в полипептидной цепи, следовательно, не нарушается первичная структура белка.
К нарушению различных связей в большинстве белков приводит прежде всего их нагревание до температуры выше 50 °С, а также ультрафиолетовое и другие виды высокоэнергетического облучения, что обусловлено усилением колебаний атомов полипептидной цепи. Денатурацию белка способны вызвать даже механические воздействия, например сильное взбалтывание раствора белка.
Скорость и степень денатурации белков при нагревании прямо зависят от температуры нагревания и его продолжительности, а также от влажности белка: в водном растворе белки денатурируют гораздо быстрее, чем в высушенном состоянии.
Денатурация белков также может происходить вследствие какого- либо химического воздействия, например в присутствии некоторых органических растворителей (спирта, ацетона и др.), мочевины, ионов тяжелых металлов и др., а также в условиях экстремальных значений pH среды.
Сильные кислоты или щелочи влияют на ионизацию кислотных и основных групп, вызывая нарушение ионных и некоторых водородных связей в молекулах белков. Напоминающая своей структурой пептидные группы молекула мочевины (H2N-CO-NH2) конкурирует с этими и другими группами в белках за образование водородных связей, нарушая их систему. Органические растворители — спирты, фенолы и другие — также нарушают в белках систему водородных связей в результате конкуренции с функциональными группами белков за их образование. Кроме этого, органические растворители вследствие установления контактов с неполярными радикалами остатков аминокислот нарушают в белках гидрофобные взаимодействия. Высокие концентрации мочевины или органических растворителей вызывают нарушение структуры воды, что также приводит к ослаблению в белковых молекулах гидрофобных взаимодействий. Слабые взаимодействия нарушают и ионы тяжелых металлов.
Дисульфидные связи в белках разрушает 2-меркаптоэтанол:
При денатурации происходит изменение свойств белка и, в первую очередь, уменьшение его растворимости. Так, при кипячении белки коагулируют и выпадают из растворов в осадок в виде сгустков. Это происходит, например, при варке куриного яйца: если медленно нагревать яичный альбумин (белок яйца), он постепенно мутнеет и, наконец, превращается в вязкий сгусток (коагулирует). После охлаждения этот белок оказывается нерастворимым. Это изменение растворимости белка является необратимым.
Осаждение белков из растворов происходит также под воздействием белковых осадителей, в качестве которых применяют реактив Барнштейна (смесь растворов гидроксида натрия и сульфата меди), раствор трихлоруксусной кислоты, уксуснокислого свинца, таннина или др.
В процессе денатурации трехмерная структура белковой молекулы нарушается, полипептидная цепь полностью или частично развертывается, молекула приобретает гораздо более рыхлую структуру. Вследствие этого повышается вязкость данного белка в растворе. Кроме того, при денатурации уменьшается водопоглотительная способность белка, т.е. его способность к набуханию; могут появляться новые химические группы, например при воздействии 2-меркаптоэтанол а — SH-группы.
Так как специфические биологические функции белка возникают на уровне его третичной или четвертичной структуры, то денатурация, сопровождающаяся нарушением этих уровней структурной организации белка, приводит к частичной или полной потере белком своей биологической активности. Например, если воздействовать на находящийся в растворе фермент трипсин возрастающими концентрациями мочевины (типичного денатурирующего агента), то по мере нарушения его вторичной и третичной структур, которое сопровождается возрастанием характеристической вязкости раствора, происходит одновременное ослабление его каталитической функции; в конце концов фермент свою функцию полностью утрачивает. Если же мочевину постепенно удалить из раствора, например методом диализа, то происходит ренатурация денатурированного белка: нативная структура, а вместе с ней и каталитическая функция трипсина восстанавливаются.
Этот опыт является примером обратимой денатурации белков, при которой их нативная конформация и нативные свойства могут быть в той или иной степени восстановлены, если убрать из среды денатурирующий агент.
Однако хотя первичная структура белка при денатурации не нарушается, денатурационные изменения в белках в большинстве случаев являются необратимыми. Примером необратимой денатурации могут служить изменения, происходящие с белком куриного яйца при его варке.
Денатурация белков имеет большое значение в явлениях живого мира. Так, по мере старения организмов происходит постепенная, хотя и очень медленная, денатурация белков, сопровождающаяся снижением их гидрофильности. Примером подобной необратимой денатурации является старение семян, которые, даже при наиболее благоприятных условиях хранения, в конце концов, теряют способность к прорастанию.
Денатурация белков имеет место и очень важна в целом ряде процессов пищевой промышленности — при выпечке хлеба и кондитерских изделий, сушке макарон, изготовлении консервов и т.д. Денатурированные (частично разрушенные) белки, как правило, значительно легче усваиваются организмом, так как в процессе пищеварения они легче гидролизуются под воздействием специфических катализаторов — ферментов. Следовательно, денатурация белков, происходящая в ходе производства пищевых продуктов, а также приготовления пищи, имеет положительное значение, так как в результате нее повышается степень усвоения белков.
Источник