Что может явиться причиной денатурации белка
Содержание статьи
Что такое денатурация белка :: SYL.ru
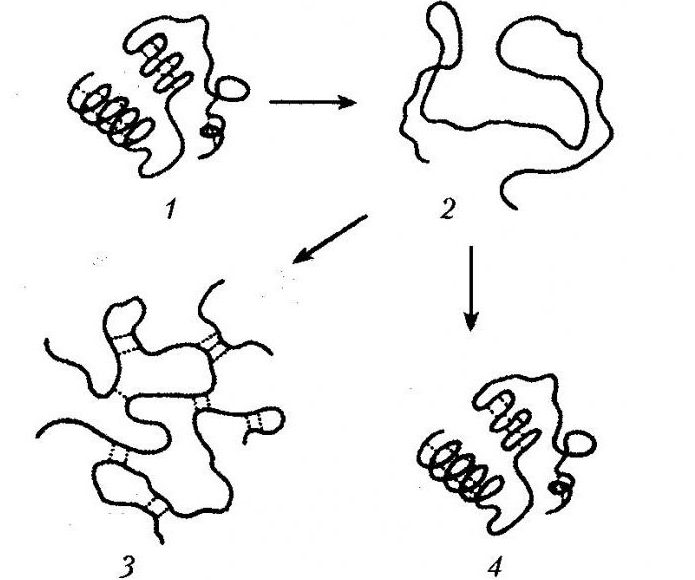
Денатурация белка — это процесс, который связан с нарушением вторичной, третичной, четвертичной структур молекулы под воздействием разных факторов.
Особенности процесса
Он сопровождается разворачиванием полипептидной связи, которая в растворе изначально представлена в виде беспорядочного клубка.
Процесс денатурации белка сопровождается утрачиванием гидратной оболочки, выпадением белка в осадок, утрачиванием им нативных свойств.
Среди основных факторов, которые провоцируют процесс денатурации, выделим физические параметры: давление, температуру, механическое действие, ионизирующее и ультразвуковое излучение.
Денатурация белка происходит под воздействием органических растворителей, минеральных кислот, щелочей, солей тяжелых металлов, алкалоидов.

Виды
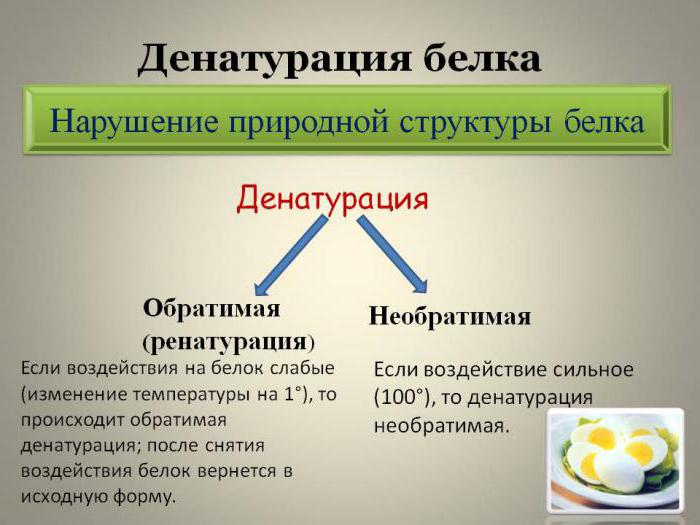
В биологии выделяют два варианта денатурации:
- Обратимая денатурация белка (ренатурация) предполагает процесс, в котором денатурированный белок после устранения всех денатурирующих веществ восстанавливается в исходную структуру. В этом случае в полном объеме возвращается биологическая активность.
- Необратимая денатурация предполагает полное разрушение молекулы, даже после удаления из раствора денатурирующих реагентов физиологичная активность не возвращается.
Особенности денатурированных белков
После того как произошла денатурация белка, он получает определенные свойства:
- В сравнении с нативной белковой молекулой увеличивается количество функциональных либо реактивных групп в молекуле.
- Уменьшается растворимость и процесс осаждения белков, чему способствует потеря водной оболочки. Происходит разворачивание структуры, появляются гидрофобные радикалы, наблюдается нейтрализация зарядов полярных фрагментов.
- Меняется конфигурация белковой молекулы.
- Утрачивается биологическая активность, причиной этого будет нарушение нативной структуры.
Последствия
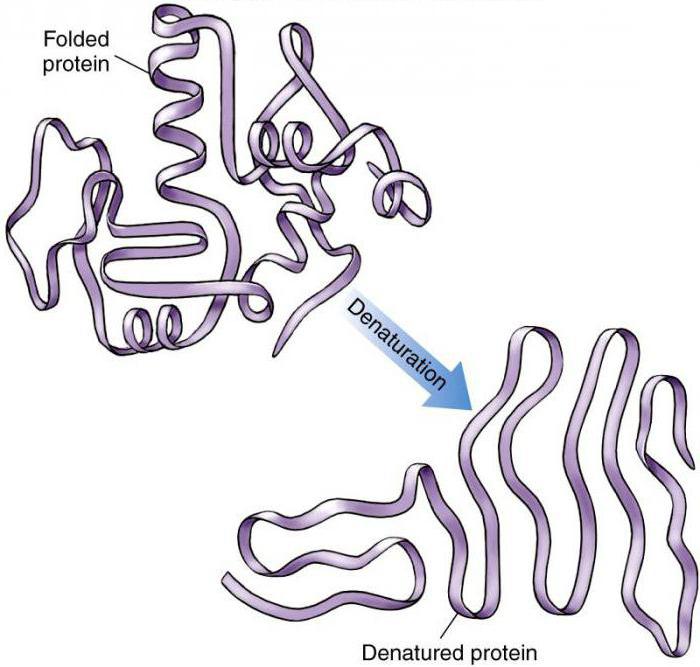
После денатурации происходит переход нативной компактной структуры в рыхлую развернутую форму, упрощается проникновение к пептидным связям ферментов, необходимых для разрушения.
Конформация белковых молекул определяется возникновением достаточного количества связей между разными участками определенной полипептидной цепочки.
Белки, состоящие из достаточного количества атомов, которые находятся в непрерывном хаотичном движении, способствует определенным перемещениям частей полипептидной цепи, что вызывает нарушение общей структуры белков, снижение его физиологических функций.
Белки имеют конформационную лабильность, то есть предрасположенность к незначительным изменениям конформации, происходящим в результате обрыва одних и образования других связей.
Денатурация белка приводит к изменениям его химических свойств, способности вступать во взаимодействие с другими веществами. Наблюдается изменение пространственной структуры и участка, непосредственно контактирующего с иной молекулой, и всей конформацией в целом. Наблюдаемые конформационные изменения имеют значение для функционирования белков в живой клетке.
Механизм разрушения
Процесс денатурации белка предполагает разрушение химических (водородных, дисульфидных, электростатических) связей, стабилизирующих высшие уровни организации молекулы белка. В результате этого меняется пространственная структура белка. Во многих ситуациях не наблюдается разрушения его первичной структуры. Это дает возможность после раскручивания полипептидной цепи стихийно скручиваться протеину, создавая «случайный клубок». В подобной ситуации наблюдается переход к беспорядочному состоянию, имеющему существенные отличия от нативной конформации.
Заключение
Температура денатурации белков превышает 56 градусов Цельсия. Типичными признаками прохождения необратимой денатурации белковых молекул считаются снижение растворимости и гидрофильности молекул, повышение оптической активности, понижение стойкости белковых растворов, увеличение вязкости.
Денатурация вызывает агрегацию частиц, они могут выпадать в осадок. Если на белок действует денатурирующий агент на протяжении незначительного временного промежутка, высока вероятность восстановления нативной белковой структуры. Данные процессы широко используют при переработке продуктов питания, консервировании, изготовлении обуви, одежды, во время сушки фруктов и овощей. Денатурацию используют в ветеринарии, медицине, клинике, фармации, при проведении биохимических исследований, связанных с осаждением в биологическом материале протеина. Далее проводится идентификация в исследуемом растворе небелковых и низкомолекулярных инстанций, в результате чего можно установить количественное содержание веществ. В настоящее время ищут способы защиты белковых молекул от разрушения.
Источник
Превращение белков при производстве пищевых продуктов
Денатурация белков
Воздействие определенных условий внешней среды на белковые молекулы в процессе производства или хранения пищевых продуктов оказывает деструктивное влияние на нековалентные связи молекулярной конструкции белка и приводит к разрушению четвертичной, третичной и вторичной структур белковой макромолекулы, называемому денатурацией.
Денатурация сопровождается изменениями важнейших свойств белка. Факторами, вызывающими денатурацию белка, являются:
— нагревание (например, тепловая обработка мясных продуктов, сворачивание белка яйца при варке);
— механическое воздействие (например, трение при взбивании яичных белков);
— действие химических реагентов – кислот, солей и др. (соление, маринование);
— все виды излучения.
Денатурация может быть полной или частичной, обратимой или необратимой.
При температурах 60-100 °С, а в некоторых случаях уже при 40 °С происходит уменьшение содержания незаменимых аминокислот в белках из-за взаимодействия между карбоксильных и аминогрупп самого белка.
Термическая денатурация белков – основной физико-химический процесс, протекающий при хлебопечении и производстве мучных и макаронных изделий, варке мяса, рыбы, овощей, консервировании, пастеризации и стерилизации молока. Денатурация является полезным процессом, поскольку способствует расщеплению белков на аминокислоты в ЖКТ.
В процессе осуществления технологических операций при температуре 100-120 °С, белоксодержащие пищевые продукты подвергаются не только денатурации, но и термической деструкции (разрушение макромолекул белка). При этом происходит разрушение пептидных связей, деполимеризация, реакции разложения. Может происходить выделение аммиака, углекислого газа и др. веществ. Образующиеся соединения обуславливают вкус и запах готового продукта. Но при этом некоторые продукты, образующиеся при термическом распаде белков (обжаривание на масле, копчение, сушка), обладают мутагенными свойствами.
Нужно избегать употребления в пищу продуктов глубокой переработки белкового сырья.
Агрегация белка
Тепловая денатурация белков часто сопровождается агрегацией денатурированных молекул. Агрегация – это взаимодействие денатурированных молекул белка, которое сопровождается образованием более крупных частиц. Внешне это выражается по-разному (например, пена на поверхности бульонов).
Агрегирующая способность белков взаимосвязана с особенностями их аминокислотного состава.
Скорость агрегирования молекул белка зависит от рН среды. Менее устойчивы белки вблизи изоэлектрической точки. Изоэлектрической точкой называют такую концентрацию водородных ионов, т.е. такое значение рН, при котором имеется равновесная концентрация положительных и отрицательных зарядов у молекул. В связи с эти для улучшения качества блюд и кулинарных изделий широко используют направленное изменение реакции среды(маринование мяса перед жаркой и т.п.).
Гидратация и дегидратация белков
Гидратацией называется способность белков прочно связывать значительное количество влаги. Если белок способен растворяться и набухать, он называется гидрофильным, если не взаимодействует с водой – гидрофобным. При определенных условиях белковые растворы набухают, превращаясь в гели. Процессы набухания играют существенную роль в пищевых процессах: набухание зерна при его замачивании, набухание муки при изготовлении теста, образование студней и желе при набухании желатина. Пшеница мягких сортов, содержащая гидрофильные белки, используется для хлебопечения, а твердые сорта пшеницы, состоящие из гидрофобных белков – для производства макаронных изделий.
Белки способны к дополнительной гидратации, от чего зависят сочность готовых изделий, способность полуфабрикатов из мяса, птицы, рыбы удерживать влагу и т.д.
Если водную оболочку удалить, то белок начинает агрегировать. Дегидратацией называется потеря белками связанной воды при сушке, замораживании и размораживании мяса и т.д.
Явление, обратное набуханию белка, представляющее собой выделение воды из геля, называется синерезисом. Именно с эти явлением связано производство сыра и творога путем удаления гидратной оболочки белка казеина. Синерезис также может иметь отрицательное значение, например, вызывать очерствение хлебобулочных изделий.
Гидролиз белков
При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, образуя смесь полипептидов, а затем протеиногенных α-аминокислот.
Для получения аминокислот и полипептидов в промышленности проводят ферментативный гидролиз биомассы дрожжей. При этом получают белковый гидролизат, аминокислоты которого применяют в качестве БАД.
Источник
Денатурация белков: сущность процесса, изменение свойств белка, виды денатурации
Денатурация — это сложный процесс, при котором под влиянием внешних факторов (температуры, механического воздействия, действия кислот, щелочей, ультразвука и др.) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т. е. нативной (естественной) пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются.
При кулинарной обработке денатурацию белков чаще всего вызывает нагревание. Процесс этот в глобулярных и фибриллярных белках происходит по-разному.
В глобулярных белках при нагревании усиливается тепловое движение полипептидных цепей внутри глобулы водородные связи, которые удерживали их в определенном положении, разрываются и полипептидная цепь развертывается, а затем сворачивается по-новому. При этом полярные (заряженные) гидрофильные группы, расположенные на поверхности глобулы и обеспечивающие ее заряд и устойчивость, перемещаются внутрь глобулы, а на поверхность ее выходят реакционноспособные гидрофобные группы (дисульфидные, сульфгидрильные и др.), не способные удерживать воду.
Денатурация сопровождается изменениями важнейших свойств белка:
потерей индивидуальных свойств (например, изменение окраски мяса при его нагревании вследствие денатурации миоглобина);
потерей биологической активности (например, в картофеле, грибах, яблоках и ряде других растительных продуктов содержатся ферменты, вызывающие их потемнение, при денатурации белки-ферменты теряют активность);
повышением атакуемости пищеварительными ферментами (как правило, подвергнутые тепловой обработке продукты, содержащие белки, перевариваются полнее и легче);
потерей способности к гидратации (растворению, набуханию);
потерей устойчивости белковых глобул, которая сопровождается их агрегированием (свертыванием, или коагуляцией, белка).
Агрегирование — это взаимодействие денатурированных молекул белка, которое сопровождается образованием более крупных частиц. Внешне это выражается по-разному в зависимости от концентрации и коллоидного состояния белков в растворе. Так, в малоконцентрированных растворах (до 1%) свернувшийся белок образует хлопья (пена на поверхности бульонов). В более концентрированных белковых растворах (например, белки яиц) при денатурации образуется сплошной гель, удерживающий всю воду, содержащуюся в коллоидной системе.
Белки, представляющее собой более или менее обводненные гели (мышечные белки мяса, птицы, рыбы; белки круп, бобовых, муки после гидратации и др.), при денатурации уплотняются, при этом происходит их дегидратация с отделением жидкости в окружающую среду. Белковый гель, подвергнутый нагреванию, как правило, имеет меньшие объем, массу, большие механическую прочность и упругость по сравнению с исходным гелем нативных (натуральных) белков. Скорость агрегирования золей белка зависит от рН среды. Менее устойчивы белки вблизи изоэлектрической точки.
Для улучшения качества блюд и кулинарных изделий широко используют направленное изменение реакции среды. Так, при мариновании мяса, птицы, рыбы перед жаркой; добавлении лимонной кислоты или белого сухого вина при припускании рыбы, цыплят; использовании томатного пюре при тушении мяса и др. создают кислую среду со значениями рН значительно ниже изоэлектрической точки белков продукта. Благодаря меньшей дегидратации белков изделия получаются более сочными.
Фибриллярные белки денатурируют иначе: связи, которые удерживали спирали их полипептидных цепей, разрываются, и фибрилла (нить) белка сокращается в длину. Так денатурируют белки соединительной ткани мяса и рыбы. Литература [4, с 118-122]
Различают 2 вида денатурации:
Обратимая денатурация — ренатурация или ренактивация — это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности.
Необратимая денатурация — это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Итак, денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Взбивание яичного белка, сливок превращает их в пену, состоящую из пузырьков воздуха, окруженных тонкими белковыми пленками, образование которых сопровождается развертыванием полипептидных цепей в результате разрыва связей при механическом воздействии. Таким образом, при образовании пленок происходит частичная или полная денатурация белка. Такой вид денатурации называется поверхностной денатурацией белка.
Для кулинарных процессов особое значение имеет тепловая денатурация белков. Механизм тепловой денатурации белков можно рассмотреть на примере глобулярных белков. Основная молекула глобулярного белка состоит из одной или нескольких полипептидных цепей, сложенных складками и образующих клубки. Такая структура стабилизируется непрочными связями, среди которых большую роль играют водородные связи, образующие поперечные мостики между параллельными пептидными цепями или их складками.
При нагревании белков начинается усиленное движение полипептидных цепей или складок, что приводит к разрыву непрочных связей между ними. Белок разворачивается и приобретает необычную, неприродную форму, водородные и другие связи устанавливаются в несвойственных данной молекуле местах, и конфигурация молекулы меняется. В результате происходит развертывание и перегруппировка складок, сопровождаемые перераспределением полярных и неполярных групп, причем неполярные радикалы концентрируются на поверхности глобул, понижая их гидрофильность. При денатурации белки становятся нерастворимыми и в большей или меньшей мере утрачивают способность к набуханию.
При длительной тепловой обработке белки подвергаются более глубоким изменениям, связанным с разрушением их макромолекул. На первом этапе изменений от белковых молекул могут отщепляться функциональные группы с образованием таких летучих соединений, как аммиак, сероводород, фосфористый водород, углекислый газ и др. Накапливаясь в продукте, они участвуют в образовании вкуса и аромата готовой продукции. При дальнейшей гидротермической обработке белки гидролизуются, при этом первичная (пептидная) связь разрывается с образованием растворимых азотистых веществ небелкового характера (например, переход коллагена в глютин). Деструкция белков может быть целенаправленным приемом кулинарной обработки, способствующим интенсификации технологического процесса.
Источник
Денатурация белка
Нативная конформация белковых молекул не является жесткой, она довольно лабильна (от лат. labilis — скользящий) и при ряде воздействий может серьезно нарушаться. Денатурацией (от лат. denaturare — лишать природных свойств) белка называется такое нарушение его нативной конформации, которое сопровождается изменением его нативных свойств, но не разрывом пептидных связей.
Таким образом, денатурация белка может быть вызвана различными относительно мягкими воздействиями, приводящими к нарушению в его молекулах слабых взаимодействий — водородных, ионных связей и гидрофобных контактов, а также к разрыву ди- сульфидных связей, стабилизирующих нативную структуру белка. При этом нарушаются вторичная, третичная и четвертичная структуры белковых молекул, но не нарушаются ковалентные связи в полипептидной цепи, следовательно, не нарушается первичная структура белка.
К нарушению различных связей в большинстве белков приводит прежде всего их нагревание до температуры выше 50 °С, а также ультрафиолетовое и другие виды высокоэнергетического облучения, что обусловлено усилением колебаний атомов полипептидной цепи. Денатурацию белка способны вызвать даже механические воздействия, например сильное взбалтывание раствора белка.
Скорость и степень денатурации белков при нагревании прямо зависят от температуры нагревания и его продолжительности, а также от влажности белка: в водном растворе белки денатурируют гораздо быстрее, чем в высушенном состоянии.
Денатурация белков также может происходить вследствие какого- либо химического воздействия, например в присутствии некоторых органических растворителей (спирта, ацетона и др.), мочевины, ионов тяжелых металлов и др., а также в условиях экстремальных значений pH среды.
Сильные кислоты или щелочи влияют на ионизацию кислотных и основных групп, вызывая нарушение ионных и некоторых водородных связей в молекулах белков. Напоминающая своей структурой пептидные группы молекула мочевины (H2N-CO-NH2) конкурирует с этими и другими группами в белках за образование водородных связей, нарушая их систему. Органические растворители — спирты, фенолы и другие — также нарушают в белках систему водородных связей в результате конкуренции с функциональными группами белков за их образование. Кроме этого, органические растворители вследствие установления контактов с неполярными радикалами остатков аминокислот нарушают в белках гидрофобные взаимодействия. Высокие концентрации мочевины или органических растворителей вызывают нарушение структуры воды, что также приводит к ослаблению в белковых молекулах гидрофобных взаимодействий. Слабые взаимодействия нарушают и ионы тяжелых металлов.
Дисульфидные связи в белках разрушает 2-меркаптоэтанол:
При денатурации происходит изменение свойств белка и, в первую очередь, уменьшение его растворимости. Так, при кипячении белки коагулируют и выпадают из растворов в осадок в виде сгустков. Это происходит, например, при варке куриного яйца: если медленно нагревать яичный альбумин (белок яйца), он постепенно мутнеет и, наконец, превращается в вязкий сгусток (коагулирует). После охлаждения этот белок оказывается нерастворимым. Это изменение растворимости белка является необратимым.
Осаждение белков из растворов происходит также под воздействием белковых осадителей, в качестве которых применяют реактив Барнштейна (смесь растворов гидроксида натрия и сульфата меди), раствор трихлоруксусной кислоты, уксуснокислого свинца, таннина или др.
В процессе денатурации трехмерная структура белковой молекулы нарушается, полипептидная цепь полностью или частично развертывается, молекула приобретает гораздо более рыхлую структуру. Вследствие этого повышается вязкость данного белка в растворе. Кроме того, при денатурации уменьшается водопоглотительная способность белка, т.е. его способность к набуханию; могут появляться новые химические группы, например при воздействии 2-меркаптоэтанол а — SH-группы.
Так как специфические биологические функции белка возникают на уровне его третичной или четвертичной структуры, то денатурация, сопровождающаяся нарушением этих уровней структурной организации белка, приводит к частичной или полной потере белком своей биологической активности. Например, если воздействовать на находящийся в растворе фермент трипсин возрастающими концентрациями мочевины (типичного денатурирующего агента), то по мере нарушения его вторичной и третичной структур, которое сопровождается возрастанием характеристической вязкости раствора, происходит одновременное ослабление его каталитической функции; в конце концов фермент свою функцию полностью утрачивает. Если же мочевину постепенно удалить из раствора, например методом диализа, то происходит ренатурация денатурированного белка: нативная структура, а вместе с ней и каталитическая функция трипсина восстанавливаются.
Этот опыт является примером обратимой денатурации белков, при которой их нативная конформация и нативные свойства могут быть в той или иной степени восстановлены, если убрать из среды денатурирующий агент.
Однако хотя первичная структура белка при денатурации не нарушается, денатурационные изменения в белках в большинстве случаев являются необратимыми. Примером необратимой денатурации могут служить изменения, происходящие с белком куриного яйца при его варке.
Денатурация белков имеет большое значение в явлениях живого мира. Так, по мере старения организмов происходит постепенная, хотя и очень медленная, денатурация белков, сопровождающаяся снижением их гидрофильности. Примером подобной необратимой денатурации является старение семян, которые, даже при наиболее благоприятных условиях хранения, в конце концов, теряют способность к прорастанию.
Денатурация белков имеет место и очень важна в целом ряде процессов пищевой промышленности — при выпечке хлеба и кондитерских изделий, сушке макарон, изготовлении консервов и т.д. Денатурированные (частично разрушенные) белки, как правило, значительно легче усваиваются организмом, так как в процессе пищеварения они легче гидролизуются под воздействием специфических катализаторов — ферментов. Следовательно, денатурация белков, происходящая в ходе производства пищевых продуктов, а также приготовления пищи, имеет положительное значение, так как в результате нее повышается степень усвоения белков.
Источник