Целиакия белок в моче
Содержание статьи
Нефропатии при целиакии
Почки могут вовлекаться в патологический процесс при целиакии как в связи с тяжелыми метаболическими нарушениями, так и в качестве ассоциированного заболевания. Так, в масштабном когортном исследовании J. F. Ludvigsson с соавт., в которое вошли 14 336 больных целиакией (диагноз был поставлен в 1964-2003 гг.) и 69 875 лиц без целиакии (группа сравнения), был показан повышенный риск развития у больных целиакией хронического гломерулонефрита, а также относительно высокая частота случаев, потребовавших проведения гемодиализа и трансплантации почки. При этом из исследования были исключены пациенты с сахарным диабетом как 1-го, так и 2-го типов [15]. В 2003 году U. Peters и соавт. [19] представили данные о более высокой смертности от болезней мочевыводящей системы и нефритов среди больных целиакией (стандартизированный уровень смертности составил 2,7 и 5,4 соответственно), по сравнению с популяцией в целом. С другой стороны, у больных с первичным гломерулонефритом часто обнаруживается увеличение интраэпителиальных Т-лимфоцитов в слизистой оболочке тонкой кишки, а также повышение проницаемости эпителиального барьера, наблюдающееся и при целиакии [21]. Данное наблюдение указывает на некоторую общность патогенетических механизмов при рассматриваемых заболеваниях, а следовательно, на возможность их ассоциации.
IgA-нефропатия при целиакии
Интерес гастроэнтерологов и нефрологов к сочетанию целиакии и IgA-нефропатии значительно вырос в последние годы. В многочисленных исследованиях, посвященных данной проблеме, антиглиадиновые IgA-антитела были выявлены у значительного числа (70-100%) больных IgA-нефропатией [11, 14, 18, 20]. В то же время типичная целиакия обнаруживается у 3-4% этих больных [5, 11].
Развитие IgA-нефропатии при целиакии непосредственно связано с глютен-опосредованным поражением кишечника, однако тонкие механизмы данного процесса остаются неясными. Хотя у пациентов с IgA-нефропатией частота выявления в крови IgA-антител к пищевым антигенам незначительно выше таковой в популяции, однако частота выявления IgA-антител к глиадину всегда значительно повышена [7].
Установлено, что пероральная иммунизация мышей глиадином способствует отложению депозитов IgA в мезангии почек, причем IgA способны фиксироваться на мезангиальных клетках с помощью опосредованных глиадином лектиновых связей [6].
Лектины представляют собой класс белков, способных быстро, избирательно и обратимо связываться с сахарами. Лектины содержатся во многих продуктах животного и растительного происхождения, а также в бактериях и вирусах, не разрушаются полностью при кулинарной обработке и могут обнаруживаться в неизмененном виде в крови.
Лектины способны образовывать обратимые связи с олигосахаридами, в т. ч. с остатками галактозы и N-ацетил-галактозамина цепей, формирующих IgA [12, 24]. Показано образование комплекса глиадина и его лектиновой фракции с полимерным IgA in vitro. В эксперименте на мышах было установлено, что введение в аорту комплекса лектин-IgA приводит к формированию содержащих IgA-мезангиальных депозитов [8].
Лектиновый механизм играет важную роль в формировании мезангиальных депозитов при целиакии. В культуре ткани было показано, что глиадин фиксируется на изолированных клубочках мышей, причем введение в среду сахаров, конкурирующих за образование связей с лектинами, предотвращало данный феномен. При этом глиадин играет важную связующую роль в отношении IgA в данном депозите [3].
R. Coppo и соавт. предположили, что глиадин может играть роль как пищевого антигена, так и энтеротоксичного лектина. В эксперименте они показали, что у мышей, которые получали в питание глиадин, значительно чаще выявляются мезангиальные депозиты, содержащие IgA (но не IgG) [6].
Однако эффект глиадина нельзя объяснить только лишь его свойствами как лектина. В том же исследовании было показано, что питание мышей соей, обладающей высокой лектиновой активностью, к формированию мезангиальных депозитов не приводит. Они также не выявили и повышения кишечной проницаемости у больных с IgA-нефропатией.
Тем не менее, глиадин играет важную, если не ключевую роль в формировании мезангиальных IgA-депозитов у больных целиакией. Было показано, что эти комплексы стимулируют продукцию мезангиальными клетками фактора некроза опухоли альфа (ФНО-альфа) и снижают продукцию простагландина Е2 (ПГЕ2), способны активировать оксидативный метаболизм лейкоцитов, их цитотоксичность и хемотаксис. Более того, безглютеновая диета у больных с IgA-нефропатией способствует снижению циркулирующих иммунных комплексов в крови, а также уровня IgA к пищевым антигенам и снижению выраженности протеинурии [6].
Дисметаболические нефропатии при целиакии
Нарушения процессов всасывания в тонкой кишке могут быть серьезной причиной дисметаболической нефропатии (в т. ч. оксалатной). Канальцевые дисфункции с гиперфосфатурией, оксалурией, цистинурией, а также рахитоподобным синдромом у больных целиакией детей известны относительно давно [2]. В работе Т. И. Корневой и соавт., в частности, у детей с целиакией были описаны нарушения канальцевого транспорта цистина и обмена триптофана, повышение экскреции с мочой аминоазота, белка, углеводов [1].
Неспецифическим фактором, способствующим формированию дисметаболической нефропатии при целиакии, является диарея. С одной стороны, диарея приводит к потере жидкости и уменьшению объема мочи с повышением ее концентрации, а с другой стороны — к нарушению обмена бикарбонатов, развитию ацидоза и закислению мочи, что снижает растворимость солей, способствуя кристаллурии.
Нарушение всасывания жирных кислот и кальция приводит к образованию кальциевых мыл, а не оксалата кальция (как это наблюдается в норме), в результате чего более растворимые оксалаты интенсивно всасываются в толстой кишке, поступают в кровь и в повышенных количествах оказываются в моче. Данный механизм, видимо, играет ключевую роль в развитии оксалатной кристаллурии. В ряде исследований было показано, что данный механизм начинает действовать при фекальной потере липидов свыше 20 г в сутки, а основным местом всасывания оксалатов является толстая кишка [10, 22]. Причем была выявлена линейная зависимость между выведением жира со стулом и содержанием оксалатов в моче. Интересно, что ограничение кальция в питании ведет к увеличению экскреции оксалатов с мочой, что указывает на важное значение формирования оксалатов кальция в кишечнике для ограничения их всасывания [23].
В экспериментальных исследованиях было показано, что оксалаты могут всасываться пассивно во всех отделах кишечника, причем этот процесс в значительной степени связан с проницаемостью кишечной стенки. Желчные кислоты (дезоксихолевая кислота) и жирные кислоты (олеиновая кислота) в эксперименте повышают проницаемость как тонкой, так и толстой кишки, одновременно повышая всасывание оксалатов [4, 9]. В тонкой кишке человека всасывание оксалатов обусловлено также активным транспортом, опосредованным белком SLC26A6, общим транспортером органических анионов.
В кишечнике всасывается 3-8% оксалатов пищи, что составляет примерно 150-250 мг в день. Стимулирует всасывание оксалатов присутствие в просвете лактата, никотината, короткоцепочечных жирных кислот. Кальций и магний связывают оксалаты в кишечнике, причем кальций — в большей степени, чем магний. Также в значительной степени оксалаты связываются пищевыми волокнами [16].
Особую роль в метаболизме оксалатов играет кишечная микрофлора, в частности, грамотрицательный микроорганизм Oxalobacter formigenes, облигатный анаэроб, обитающий в толстой кишке. Для обеспечения его энергетического метаболизма требуются углеводы и обязательно оксалаты. При этом метаболизм оксалата усиливается в кислой среде. На первом году жизни наблюдается увеличение численности популяции O. formigenes, в 6-8 лет он обнаруживается практически у всех детей, а у взрослых — в 60-80% случаев. Активно утилизируя оксалаты, он уменьшает их содержание в кишечном содержимом, снижая его поступление в организм из толстой кишки [17].
Связь O. formigenes с особенностями метаболизма оксалатов у больных и здоровых лиц была показана во многих исследованиях. В частности, у лиц, у которых данный микроорганизм отсутствовал в кишечном микробиоценозе, экскреция оксалатов с мочой достоверно выше, по сравнению с лицами, чей кишечник им заселен. При этом среди лиц с оксалурией O. formigenes выявляется не более чем в 45% случаев [13, 25]. Следовательно, отсутствие в толстой кишке O. formigenes является определенным фактором риска развития оксалурии.
Однако утилизировать оксалаты способен не только O. formigenes. Лактобактерии, энтерококки, эубактерии также их метаболизируют, однако низкая концентрация оксалатов не является критической для их жизнедеятельности [26].
Таким образом, нарушения кишечного микробиоценоза, развивающиеся при целиакии, также способны привести к увеличению поступления в организм оксалатов. Следует отметить также, что при целиакии наблюдается нестабильность клеточных мембран, обусловленная белково-энергетической недостаточностью. При этом с мочой увеличивается экскреция метаболитов фосфолипидов, у 2/3 детей выявляется фосфатная кристаллурия и у 1/2 — оксалатная.
Наконец, нарушение всасывания витаминов, в частности, витаминов группы В (в первую очередь, витамина В6), приводит к нарушению обмена глицина и глиоксиловой кислоты, способствуя повышенному экзогенному синтезу и экскреции оксалатов.
Метаболические механизмы нарушения функции почек при целиакии
Метаболические нарушения при целиакии, включая белково-энергетическую недостаточность и нарушения водно-электролитного обмена, неспецифическим образом могут влиять на функцию почек. Механизмы этих нарушений можно представить следующим образом:
- Дефицит энергетического материала (углеводов и жиров).
- Дефицит белков как пластического материала.
- Снижение почечного кровотока и уменьшение клубочковой фильтрации в результате:
- уменьшения объема циркулирующей жидкости (из-за диареи);
- спазма периферических сосудов на фоне уменьшения объема циркулирующей жидкости;
- сгущения крови.
- Гипоксия почки как результат снижения почечного кровотока.
Результатом перечисленных выше механизмов является нарушение функции почек различной степени выраженности от транзиторных до тяжелой почечной недостаточности. К счастью, последняя, следует отметить, при целиакии наблюдается редко.
Диарея, независимо от ее происхождения, способна вызвать каскад неспецифических изменений водно-электролитного обмена, порой тяжелых и угрожающих жизни.
Простое ускорение моторики кишечника неизбежно приводит к потере значительного количества жидкости и электролитов, пропорционально их содержанию в том или ином отделе пищеварительного тракта. Помимо воды, в значительной степени теряются натрий, калий и бикарбонаты. Потери усугубляются при увеличении потока воды и электролитов при осмотической или секреторной диарее. В результате этого развивается изотоническая и в дальнейшем гипотоническая дегидратация организма.
Общая стратегия организма при диарее заключается в восстановлении объема воды и натрия в организме путем уменьшения их потери через почки. Реализуется это снижением процесса почечной фильтрации и повышением реабсорбции. Кроме того, происходит централизация кровообращения за счет ограничения доступа жидкости к периферическим тканям.
Снижение объема циркулирующей жидкости могло бы задействовать еще один компенсаторный механизм: повышение онкотического давления крови вследствие относительного увеличения концентрации белка (уменьшение объема жидкости без изменения количества белка) и выход жидкости из интерстициального пространства в сосуды. Однако при целиакии имеет место гипопротеинемия, в связи с чем этот механизм оказывается недееспособным.
Принципы терапии нефропатий при целиакии
Поражения почек при целиакии носят вторичный характер, поэтому эффективное ее лечение является основой успешной терапии нефропатий.
Течение и прогноз IgA-нефропатии напрямую связан с активностью целиакии, и контроль над ней позволяет добиться контроля над течением нефропатии. Непосредственное лечение IgA-нефропатии, при необходимости, осуществляется по общепринятым схемам. По достижении ремиссии заболевания больные должны находиться под наблюдением нефролога с контролем основных показателей не реже 2-4 раз в год и при возникновении интеркуррентных заболеваний.
Лечение больных с оксалатной нефропатией включает диетический и водный режим, медикаментозную терапию.
Назначается картофельно-капустная диета, при которой снижается поступление оксалатов с пищей и нагрузка на тубулярный аппарат. Необходимо исключить экстрактивные мясные блюда, богатые оксалатами щавель, шпинат, клюкву, свеклу, морковь, какао, шоколад и др. «Подщелачивающий» эффект оказывают курага, чернослив, груши.
Важно обеспечить высокожидкостной режим, до 2 л в сутки, с обязательным употреблением жидкости в ночное время для снижения концентрации мочи и уменьшения склонности к кристаллообразованию. Из минеральных вод используются воды типа «Славяновской» и «Смирновской» по 3-5 мл/кг/сут в 3 приема курсом 1 месяц 2-3 раза в год.
Медикаментозная терапия включает мембранотропные препараты и антиоксиданты (витамины А, Е, В6, Ксидифон, Димефосфон, Цистон, магния оксид или комбинированный препарат Магне В6 и др.). Лечение должно быть упорным и длительным.
Литература
- Корнева Т. И. Клинико-биохимическая диагностика и лечение синдрома нарушенного кишечного всасывания у детей. М., 1973. 138 с.
- Фадеева М. А., Лебедев В. П., Вербицкий В. И. и др. Патология мочевой системы при синдроме нарушенного кишечного всасывания. В кн.: Синдром нарушенного кишечного всасывания у детей. М., 1985. С. 53-55.
- Amore A., Emancipator S. N., Coppo R. et al. Specific binding of gliadin to rat mesangial cells in culture // Nephnol Dial Transplant. 1988. Vol. 3. P. 524.
- Binder H. J. Intestinal oxalate absorption //Gastroenterology. 1974. Vol. 67. P. 441.
- Collin P., Syrjanen J., Partanen J., Pasternack A., Kaukinen K., Mustonen J. Celiac disease and HLA DQ in patients with IgA nephropathy // Am J Gastroenterol. 2002. Vol. 97. P. 2572-2576.
- Coppo R., Amore A., Roccatelbo D. Dietary Antigens and Primary Immunoglobulin A Nephropathy // J. Am. Soc. Nephrol. 1992. Vol. 2. P. S173-S180.
- Coppo R., Amore A., Roccatello D. et al. IgA antibodies to dietary antigens and bectin-binding IgA in sera from Italian, Australian, and Japanese IgA nephropathy patients // Am J Kidney Dis. 1991. Vol. 17. P. 480-487.
- Davin J. C., Dechenne C., Lombet J., Rentier B., Foidart J. B., Mahieu P. R. Acute experimental gbmerulonephnitis induced by the gbomerulan deposition of circulating polymeric IgA-concaalin A complexes // Virchows Arch. 1989. Vol. 415. P. 7-20.
- Dobbins J. W., Binder H. J. Effect of bile salts and fatty acids on the colonic absorption of oxalate // Gastroenterology. 1976. Vol. 70. P. 1096.
- Eversmann J. J., Farmer R. G., Brown C. H. et al. Gastrointestinal manifeions of hyperparathyroidism // Arch. Internal Med. 1967. Vol. 119. P. 605.
- Fornasieri A., Sinico P. A., Maldifassi P., Benascorn P., Vegni M., D’Amico G. IgA-antigliadin antibodies in IgA mesangial nephropathy (Berger’s disease) // Br Med J. 1988. Vol. 295. P. 78-80.
- Kondoh H., Kobayashi K., Hagiwara K., Kajii T. Jacalin, a jackfruit lectin, precipitates IgA1 but not IgA2 subclass on gel diffusion reaction // J Immunol Methods. 1986. Vol. 80. P. 171-173.
- Kwak C., Kim H. K., Kim E. C., Choi M. S., Kim H. H. Urinary oxalate levels and the enteric bacterium Oxalobacter formigenes in patients with calcium oxalate urolithiasis // Eur Urol. 2003. Vol. 44 (4). P. 475-81.
- Laurent J., Branellec A., Heslan J. M. et al. An increase in circulating IgA antibodies to gliadin in IgA mesangial gbomerubonephnitis // Am J Nephrol. 1987. Vol. 7. P. 178-183.
- Ludvigsson J. F., Montgomery S. M., Olen O., Ekbom A., Ludvigsson J., Fored M. Coeliac disease and risk of renal disease — a general population cohort study // Nephrol Dial Transplant. 2006. Vol. 21. P. 1809-1815.
- Massey L. K. Dietary influences on urinary oxalate and risk of kidney stones // Front Biosci. 2003. Vol. 8. P. 584-594.
- Mittal R. D., Kumar R. Gut-inhabiting bacterium Oxalobacter formigenes: role in calcium oxalate urolithiasis // J. Endourol. 2004. Vol. 18 (5). P. 418-424.
- Nagy J., Scott H., Brandtzaeg P. Antibodies to dietary antigens in IgA nephropathy // Cbin Nephrol. 1988. Vol. 29. P. 275-279.
- Peters U., Askling J., Gridley G., Ekbom A., Linet M. Causes of death in patients with celiac disease in a population-based Swedish cohort // Arch Intern Med. 2003. Vol. 163. P. 1566-1572.
- Rodriguez-Soriano J., Arrieta A., Vallo A., Sebastian M. J., Vitoria J. C., Masdevall M. D. IgA antigliadin antibodies in children with IgA mesangial glomerulonephritis // Lancet. 1988. Vol. 1. P. 1109-1110.
- Rostoker G., Delchier J. C., Chaumette M. T. Increased intestinal intra-epithelial T lymphocytes in primary glomerulonephritis: a role of oral tolerance breakdown in the pathophysiology of human primary glomerulonephritides? // Nephrol Dial Transplant. 2001. Vol. 16. P. 513-517.
- Saunders D. R., Sillery J., McDonald G. B. Regional differences in oxalate absorption by rat intestine: evidence for excessive absorption by the colon in steatorrhea // Gut. 1975. Vol. 16. P. 543.
- Stauffer J. Q. Hyperoxaluria and calcium oxalate nephrolithiasis after jejunoileal bypass // Am. J. Clin. Nutr. 1977. Vol. 30. P. 64-71.
- Stockert R. J., Kressner M. S., Collins J. C. IgA interaction with the asiabogbycoprotein receptor // Proc Natl Acad Sci USA. 1982. Vol. 79. P. 6229-6235.
- Troxel S. A., Sidhu H., Kaul P., Low R. K. Intestinal Oxalobacter formigenes colonization in calcium oxalate stone formers and its relation to urinary oxalate // J. Endourol. 2003. Vol. 17 (3). P. 173-176.
- Weese J. S., Weese H. E., Yuricek L., Rousseau J. Oxalate degradation by intestinal lactic acid bacteria in dogs and cats // Vet Microbiol. 2004. Vol. 101 (3). P. 161-166.
А. В. Малкоч, кандидат медицинских наук, доцент
С. В. Бельмер, доктор медицинских наук, профессор
ГБОУ ДПО РМАПО Минздравсоцразвития России,
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития России, Москва
Контактная информация об авторах для переписки: malkoch@mail.ru
Источник
Целиакия (Глютеновая энтеропатия)
Целиакия — это генетически обусловленное нарушение функции тонкого кишечника, связанное с дефицитом ферментов, расщепляющих пептид глютен. При целиакии развивается синдром мальабсорбции различной степени выраженности, сопровождающийся пенистой диареей, метеоризмом, похуданием, сухостью кожи, задержкой физического развития детей. Для выявления целиакии применяются иммунологические методы (определение Ат к глиадину, эндомизию, тканевой трансглутаминазе), биопсия тонкой кишки. При подтверждении диагноза требуется пожизненное соблюдения безглютеновой диеты, проведение коррекции дефицита необходимых веществ.
Общие сведения
Целиакия (глютеновая энтеропатия) — заболевание, характеризующееся хроническим воспалением слизистой тонкого кишечника, сопровождающимся нарушением всасывания и возникающим в результате непереносимости глютена (белка, который содержится в хлебных злаках: пшеницы, ржи и ячмене). В состав белка глютена входит L-глиадин — вещество, оказывающее токсическое действие на слизистую и ведущее к нарушению абсорбции питательных веществ в кишечнике.
Заболевание более характерно для женщин, они страдают целиакией в два раза чаще мужчин. Чаще всего (в 85% случаев) полное исключение глютена из рациона вызывает восстановление функциональности тонкого кишечника через 3-6 месяцев.
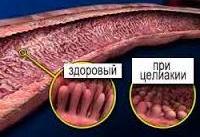
Целиакия
Причины целиакии
Целиакия имеет генетическую предрасположенность. Это подтверждается выявлением нарушений со стороны тонкокишечной стенки у 10-15 % членов семей (родственников первой степени) пациентов, страдающих этим заболеванием.
Также отмечена зависимость заболеваемости от иммунного статуса. В организме больных целиакией отмечают повышение титров антител к L-глиадину, тканевой трансглутаминазе и эндомиозину (белку, содержащемуся в гладкомышечных волокнах). Подтверждают иммунную зависимость заболевания и нередко сопутствующие патологии, имеющие аутоиммунный характер:
- сахарный диабет I типа;
- заболевания соединительной ткани;
- ювенильный ревматоидный артрит;
- аутоиммунный тиреоидит;
- герпетиформный дерматит;
- синдром Шегрена.
Патогенез
Некоторые врожденные или приобретенные особенности работы тонкого кишечника способствуют возникновению повышенной чувствительности клеток кишечного эпителия к глиадину. К таким состояниям относится ферментная недостаточность, в результате которой плохо расщепляются пептиды (и не происходит полного расщепления глиадина). Накопление глиадина в кишечнике способствует проявлению его токсического действия.
Аутоиммунные нарушения в тех случаях, когда мишенью для собственных антител становятся эпителиальные клетки кишечника, способствуют снижению их защитных свойств и повышению чувствительности к глиадину. Помимо этого, факторами, способствующими возникновению непереносимости глиадина, являются генетически обусловленные специфические характеристики рецепторов клеточной мембраны кишечного эпителия, а также результат изменения рецепторного аппарата некоторыми вирусами. При целиакии отмечаются характерные атрофические изменения ворсинок слизистой оболочки тонкого кишечника.
Классификация
В клинической гастроэнтерологии различают три формы течения целиакии:
- типичная (развивается на первом-втором году жизни, имеет характерные клинические проявления);
- стертая (проявляется внекишечной симптоматикой: железодефицит, анемия, кровоточивость, остеопороз);
- латентная (без выраженных жалоб), часто встречается у лиц пожилого возраста.
Симптомы целиакии
Клинические признаки целиакии — это диарея, стеаторея, похудание, полигиповитаминозы и прочие проявления синдрома мальабсорбции. У женщин развитие клинических симптомов начинается в 30-40 лет, у мужчин в 40-50.
Целиакия у детей начинает проявляться обычно в 9-18 месяцев. Появляется частый и жидкий стул с большим количеством жира и отмечается снижение массы тела, отставание в росте. У взрослых развертывание клинических симптомов целиакии может быть спровоцировано беременностью, перенесенными оперативными вмешательствами, инфекцией. Лица, страдающие целиакией, зачастую отмечают склонность к сонливости, сниженной работоспособности, часто урчание в животе, метеоризм, неустойчивость стула (поносы, сменяющиеся запорами). У пожилых пациентов могут отмечаться боли и ломота в костях, мышцах.
Стул, как правило, частый (5 и более раз в день), жидкий, пенистый с остатками непереваренной пищи. При продолжительной диарее есть вероятность развития признаков обезвоживания: сухость кожных покровов и слизистых оболочек. Прогрессирование синдрома мальабсорбции ведет к развитию тяжелых расстройств внутреннего гомеостаза организма.
Осложнения
Больные целиакией относятся к группе повышенного риска возникновения рака кишечника (кишечной лимфомы, аденокарциномы). Этот вид злокачественной опухоли развивается у 6-8% больных, чаще всего после 50 лет. Возникновение злокачественного новообразования подозревают в том случае, если клинические проявления целиакии возобновились на фоне безглютеновой диеты.
Еще одним вероятным осложнением целиакии является язвенный еюноилеит (воспаление со склонностью к изъязвлению стенки тощей и подвздошной кишок). Характеризуется развитием острой болезненности в животе, лихорадкой. Развитие этого состояния грозит внутренним кровотечением, прободением стенки тонкого кишечника, перитонитом. При выраженной недостаточности всасывания железа развивается железодефицитная анемия. Иногда она становится единственным проявлением заболевания (при стертой и латентной форме).
Нарушения фертильности, бесплодие могут быть результатом длительно существующего синдрома мальабсорбции. Также продолжительное нарушение всасывания ведет к полигиповитаминзам, белковой недостаточности, нарушениям минерального обмена. Недостаток витамина D в сочетании с пониженным поступлением кальция в организм способствует снижению плотности костей, их ломкости. В 30-35% случаев у больных целиакией уменьшается в размерах селезенка, 70% пациентов отмечают артериальную гипотензию.
Диагностика
Диагностика целиакии проводится врачом-гастроэнтерологом. Используется комплекс функциональных, лабораторных, инструментальных (лучевых и эндоскопических методов):
- Определение специфических антител. Наиболее специфичной методикой выявления целиакии является определение в крови антител к глиадину и антител к тканевой трансглутаминазе. Чувствительность методики составляет 100%, ее специфичность для данной патологии порядка 95-97%.
- Эндоскопическая биопсия. Производится эндоскопическое исследование тонкого кишечника, биопсия слизистой для определения имеющейся атрофии (сглаживания) ворсин, а также наличия скоплений лимфоцитов в слизистой.
- Инструментальные методы. Дополнительными методиками для уточнения состояния больного являются УЗИ органов брюшной полости, компьютерная томография, МРТ-ангиография мезентериальных сосудов, контрастная рентгеноскопия кишечника.
- Функциональные тесты. С целью оценки всасывательной способности тонкого кишечника выполняются тест Шиллинга и проба с D-ксилозой.
Лечение целиакии
 Цель терапии при целиакии — восстановление функций кишечника, нормализация массы тела и коррекция дефицита необходимых веществ.
Цель терапии при целиакии — восстановление функций кишечника, нормализация массы тела и коррекция дефицита необходимых веществ.
Безглютеновая диета
Патогенетическое лечение заключается в соблюдении аглютеновой диеты, то есть непосредственное избегание действия повреждающего фактора. Соблюдать безглютеновую диету необходимо на протяжении всей жизни. Чаще всего (в 85% случаев) эта мера приводит к стиханию симптомов и восстановлению нормальной деятельности кишечника.
Глютен содержится в следующих продуктах: хлеб и любые изделия из пшеничной, овсяной, ячменной и ржаной муки, макаронные изделия, манная крупа. В небольших концентрациях глютен может обнаруживаться в колбасах и сосисках, мясных и рыбных консервах, шоколаде, мороженом, майонезе и кетчупе, различных соусах, растворимом кофе и порошке какао, продуктах из сои, супах быстрого приготовления, бульонных кубиках, продуктах, содержащих солодовый экстракт. Из напитков необходимо отказаться от пива, кваса, водки.
Зачастую больным целиакией следует ограничить употребление цельного молока, поскольку у них может отмечаться непереносимость лактозы (молочного сахара). В настоящее время в продаже имеются специальные диетические безглютеновые продукты (маркированы перечеркнутым колосом).
Как правило, окончательное восстановление происходит не ранее чем через 3-6 месяцев, поэтому корректировать содержание необходимых организму веществ требуется на протяжении всего времени выздоровления. При необходимости назначают парентеральное питание, введение препаратов железа и фолиевой кислоты, солевые растворы, кальций, витамины.
Медикаментозная терапия
Тем пациентам, которые не обнаруживают положительного эффекта диеты, назначаются гормональные препараты (преднизолон) на протяжении 6-8 недель в качестве противовоспалительной терапии.
Отсутствие положительной динамики при исключении глютена из рациона в течение трех месяцев может говорить о том, что диета соблюдается не полностью, с нарушениями, либо имеются сопутствующие заболевания (недостаточность дисахаридазы, болезнь Аддисона, лимфома тонкого кишечника, язвенный еюнит, лямблиоз, недостаток минералов в рационе: железа, кальция, магния).
В таких случаях проводятся дополнительные диагностические мероприятия для выявления этих состояний. При исключении всех возможных причин отсутствия улучшений назначают гормональную терапию. Через три месяца курса преднизолона проводят биопсию тонкого кишечника.
Прогноз
Корректировать чувствительность клеток эпителия к глютену в настоящее время не представляется возможным, поэтому больные целиакией должны соблюдать безглютеновую диету на протяжении всей жизни. Тщательное ее соблюдение ведет к сохранению качества и продолжительности жизни. При несоблюдении диеты выживаемость резко падает, случаи летального исхода среди больных целиакией, нарушающих безглютеновую диету, составляют 10-30%, в то время как при строгом следовании диете этот показатель не превышает одного процента.
Все лица, страдающие целиакией, должны находиться на диспансерном учете у гастроэнтеролога и ежегодно проходить обследование. Для больных, которые слабо реагируют на исключение глютена из рациона, диспансерное наблюдение показано дважды в год. Прогноз заметно ухудшается, если это заболевание осложняется возникновением лимфомы тонкого кишечника.
Профилактика
Первичной специфической профилактики целиакии не существует. Вторичная профилактика развития клинических симптомов заключается в соблюдении безглютеновой диеты. При имеющейся у ближайших родственников целиакии желательно проводить периодическое обследование на предмет выявления специфических антител. Беременные женщины, страдающие целиакией, попадают в группу риска по развитию пороков сердца у плода. Ведение беременности у таких женщин должно осуществляться с повышенным вниманием.
Источник