Белок в моче сульфосалициловым методом
Содержание статьи
БЕЛОК В МОЧЕ АГАТ
по применению набора реактивов для определения белка в моче с сульфосалициловой кислотой
НАЗНАЧЕНИЕ
Диагностический набор предназначен для количественного определения содержания белка в моче по помутнению, образовавшемуся при добавлении сульфосалициловой кислоты. Для клинико-диагностических и биохимических лабораторий. Набор рассчитан на 660 определений при расходе 3,0 мл раствора сульфоофосалициловой кислоты на один анализ.
ПРИНЦИП МЕТОДА
Интенсивность помутнения при коагуляции белка сульфосалициловой кислотой, измеренная по оптической плотности при 620 нм, пропорциональна его концентрации. Калибровка осуществляется по раствору человеческого сывороточного альбумина.
СОСТАВ НАБОРА
1. 5-сульфосалициловая кислота, дигидрат, 30 г — 2 упаковки;
2. Калибровочный раствор альбумина 1000 мг/л, 10 мл — 1 флакон.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Сульфосалициловая кислота — едкое вещество. В случае попадания раствора на кожу и (или) слизистые необходимо сразу же промыть пораженное место большим количеством воды. Пипетирование per os категорически запрещается. Другие компоненты набора в используемых концентрациях являются нетоксичными. При работе с сывороткой или плазмой крови необходимо соблюдать правила техники безопасности принятые в лаборатории, т.к. образцы человеческой крови следует рассматривать как потенциально инфицированые.
ОБОРУДОВАНИЕ И РЕАГЕНТЫ
— Спектрофотометр, длина волны 620 нм или фотоэлектроколориметр, длина волны 590-650 нм (оранжевый или красный светофильтр), кювета с толщиной поглощающего свет слоя 10 мм;
— пипетки, позволяющие отбирать объемы жидкости от 0,25 до 5,0 мл; — пробирки вместимостью 5,0-10 мл;
— колба мерная вместимостью 1000 мл;
— секундомер;
— вода дистиллированная;
— раствор натрия хлористого, 9 г/л;
— перчатки резиновые или пластиковые.
АНАЛИЗИРУЕМЫЕ ОБРАЗЦЫ
Моча профильтрованная.
ПОДГОТОВКА РЕАГЕНТОВ ДЛЯ АНАЛИЗА
Раствор сульфосалициловой кислоты. Содержимое одной упаковки (30 г) с сульфосалициловой кислотой количественно переносят в мерную колбу вместимостью 1000 мл, растворяют в дистиллированной воде и доводят объем до метки. Раствор стабилен.
ПРОВЕДЕНИЕ АНАЛИЗА
В пробирки вносят реактивы по следующей схеме:
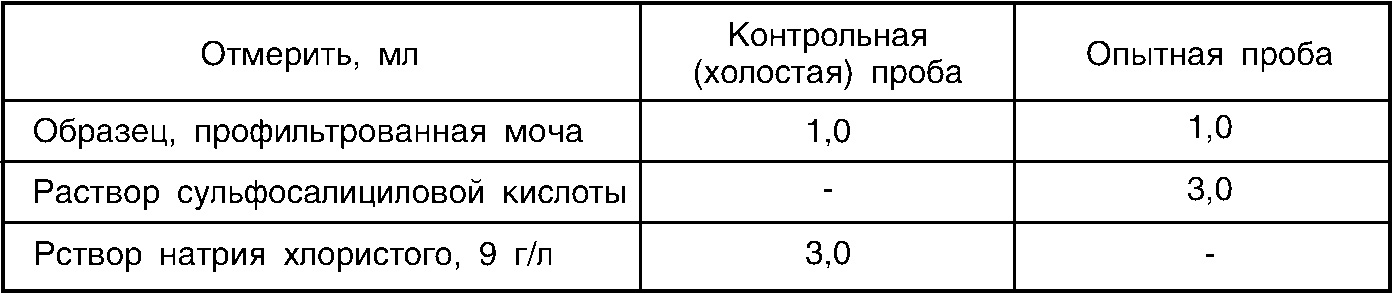
Содержимое пробирок тщательно перемешивают и выдерживают при температуре +18-22° С в течение 10 минут. Определяют оптическую плотность опытной пробы при длине волны 620 нм (590-650 нм, оранжевый или красный светофильтр) против холостой пробы в кювете с толщиной слоя 10 или 5 мм. При стоянии образцов более 20 минут возможно уменьшение значений оптической плотности за счет оседания части преципитата. Непосредственно перед измерением пробирку с опытной пробой тщательно встряхнуть. Расчет проводят по калибровочному графику.
Построение калибровочного графика
Для построения калибровочного графика из калибровочного раствора альбумина и 9 г/л раствора натрия хлористого готовят следующие разведения:
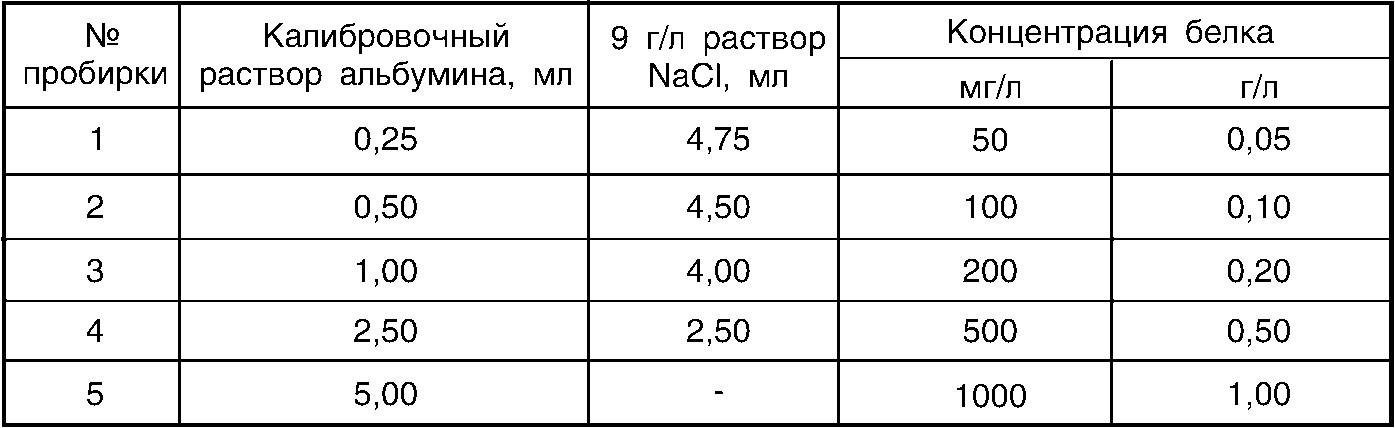
Полученные разведения обрабатывают так же, как и образец.
Примечания: Линейная зависимость сохраняется до концентрации белка 1 г/л. При более высоких концентрациях пробу следует развести в 2-3 раза, результат умножить на разведение. Результаты, получаемые данным методом чувствительны к изменениям температуры. Рекомендуется производить измерения при температуре +18-22° С. Ложноположительные результаты могут быть получены при наличии в моче контрастных веществ, содержащих органический йод. Поэтому тест нельзя использовать у лиц, принимающих препараты йода. Ложноположительный тест может быть также обусловлен приемом сульфаниламидных препаратов, больших доз пенициллина и при высоких концентрациях в моче мочевой кислоты.
УСЛОВИЯ ХРАНЕНИЯ И ЭКСПЛУАТАЦИИ
Набор следует хранить в упаковке предприятия-изготовителя при температуре +2-8° С в течение всего срока годности. Срок годности набора — 2 года.
Литература: Лабораторные методы исследования в клинике. Под редакцией проф. В.В. Меньшикова, М., 1987, с. 49.
По вопросам, касающимся приобретения наборов и их качества, просим обращаться по адресу: 105173, г. Москва, ул. Западная, д. 2, стр. 1, ООО «Агат-Мед». Телефон для справок: (495) 777-41-92.
Инструкция составлена: к.б.н. И.В. Смирновым — зав. лабораторией ГНЦ РАМН, В.В. Гладуном — главным технологом ООО «Агат-Мед».
Источник
Белок в моче – методы определения и границы нормы (современное состояние проблемы)
ЮНИТЕКА:
Анализ мочи:
26.02.2009
Куриляк О.А., к.б.н.
В норме белок выделяется с мочой в относительно небольшом количестве, обычно не более 100-150 мг/сут.
Суточный диурез у здорового человека составляет 1000-1500 мл/сут; таким образом, концентрация белка в физиологических условиях составляет 8-10 мг/дл (0,08-0,1 г/л).
Общий белок мочи представлен тремя основными фракциями — альбуминами, мукопротеинами и глобулинами.
Альбумин мочи — это та часть альбумина сыворотки крови, которая была профильтрована в клубочках и не была реабсорбирована в почечных канальцах; в норме экскреция альбумина в моче составляет менее 30 мг/сут. Иным главным источником белка в моче служат почечные канальцы, особенно дистальная часть канальцев. Эти канальцы секретируют две третьих общего количества мочевого белка; из этого количества примерно 50% представлено гликопротеидом Тамма‑Хорсфалла, который секретируется эпителием дистальных канальцев и играет важную роль в формировании мочевых камней. Иные белки присутствуют в моче в незначительном количестве и происходят из профильтровавшихся через почечный фильтр низкомолекулярных белков плазмы, которые не реабсорбируются в почечных канальцах, микроглобулинов из эпителия почечных канальцев (RTE), а также простатического и влагалищного отделяемого.
Протеинурия, то есть увеличение содержания белка в моче — один из наиболее значимых симптомов, отражающий поражение почек. Однако и целый ряд других состояний также может сопровождаться протеинурией. Поэтому различают две основные группы протеинурий: почечную (истинную) и внепочечную (ложную) протеинурию.
При почечной протеинурии белок проникает в мочу непосредственно из крови вследствие повышения проницаемости гломерулярного фильтра. Почечная протеинурия часто встречается при гломерулонефрите, нефрозе, пиелонефрите, нефросклерозе, амилоидозе почек, различных формах нефропатий, например нефропатии беременных, лихорадочных состояниях, гипертонической болезни и т.д. Протеинурия может обнаруживаться и у здоровых людей после тяжелых физических нагрузок, переохлаждения, психологического стресса. У новорожденных в первые недели жизни наблюдается физиологическая протеинурия, а при астении у детей и подростков в сочетании с быстрым ростом в возрасте 7-18 лет возможна ортостатическая протеинурия (в вертикальном положении тела).
При ложной (внепочечной) протеинурии источником белка в моче является примесь лейкоцитов, эритроцитов, клеток эпителия мочевых путей уротелия. Распад этих элементов, особенно резко выраженный при щелочной реакции мочи, приводит к попаданию белка в мочу, уже прошедшую почечный фильтр. Особенно высокую степень ложной протеинурии дает примесь крови в моче, при профузной гематурии она может достигать 30 г/л и более. Заболевания, которые могут сопровождаться внепочечной протеинурией — мочекаменная болезнь, туберкулез почки, опухоли почки или мочевых путей, циститы, пиелиты, простатиты, уретриты, вульвовагиниты.
Клиническая классификация включает легкую протеинурию (менее 0,5 г/сут.), умеренную (от 0,5 до 4 г/сут.), или тяжелую (более 4 г/сут.).
У большинства пациентов с заболеваниями почек, такими, как острый гломерулонефрит или пиелонефрит выявляют умеренную протеинурию, но больные с нефротическим синдромом обычно выделяют с мочой более 4 г белка ежедневно.
Для количественного определения белка применяется широкий спектр методов, в частности, унифицированный метод Брандберга-Робертса-Стольникова, биуретовый метод, метод с применением сульфосалициловой кислоты, методы с использованием красителя кумасси синий, красителя пирогаллоловый красный и др.
Использование различных методов определения белка в моче привело к тому, что в трактовке границ нормы содержания белка в моче возникла серьезная путаница. Поскольку наиболее часто в лабораториях используются 2 метода — с сульфосалициловой кислотой и красителем пирогаллоловый красный, рассмотрим проблему корректности границ норм именно для них. С позиции сульфосалицилового метода в нормальной моче содержание белка не должно превышать 0,03 г/л, с позиции же пирогаллолового — 0,1 г/л! Различия троекратные!!!
Низкие значения нормы концентрации белков в моче при использовании сульфосалицилового обусловлены следующими моментами:
- калибровочная кривая строится по водному раствору альбумина. Моча по своему составу очень сильно отличается от воды: рН, соли, низкомолекулярные соединения (креатинин, мочевина и др). Вследствие этого по данным Альтшулера, Ракова и Ткачева ошибка определения белка в моче может быть 3-х кратной и более! Т.е. корректные результаты определения могут быть получены только в тех случаях, когда моча имеет очень низкий удельный вес и по своему составу и рН приближается к воде;
- более высокая чувствительность сульфосалицилового метода к альбумину в сравнении с другими белками (в то время, как было упомянуто выше, альбумин в нормальных образцах мочи составляет не более 30% от общего белка мочи);
- если pH мочи сдвинута в щелочную сторону, происходит нейтрализация сульфосалициловой кислоты, что так же является причиной занижения результатов определения белка;
- скорость седиментации преципитатов подвержена значительной вариации — при невысоких концентрациях белка преципитация замедлена, и ранняя остановка реакции приводит к занижению результата;
- скорость реакции преципитации существенно зависит от перемешивания реакционной смеси. При высоких концентрациях белка активное встряхивание пробирки может приводить к образованию крупных хлопьев и их быстрому осаждению.
Все выше перечисленные особенности метода и приводят к значительному занижению определяемой в моче концентрации белка. При этом степень занижения сильно зависит от состава конкретной пробы мочи. Поскольку метод сульфосалициловой кислоты дает заниженные значения концентрации белка то и граница нормы для этого метода 0,03 г/л тоже занижена примерно в три раза в сравнении с данными, которые приводятся в зарубежных справочниках по клинической лабораторной диагностике.
Подавляющее большинство лабораторий западных стран отказались от применения сульфосалицилового метода для определения концентрации белка в моче и активно используют для этих целей пирогаллоловый метод. Пирогаллоловый метод определения концентрации белка в моче и других биологических жидкостях основан на фотометрическом принципе измерения оптической плотности окрашенного комплекса, образующегося при взаимодействии молекул белка с молекулами комплекса красителя пирогаллоловый красный и молибдата натрия (Pyrogallol Red-Molyb complex).
Почему пирогаллоловый метод позволяет получать более точные результаты измерения концентрации белка в моче? Во-первых, за счет большей кратности разведения пробы мочи в реакционной смеси. Если в сульфосалициловом методе отношение проба мочи/реагент составляет 1/3, то в пирогаллоловом методе оно может быть в пределах от 1/12,5 до 1/60 в зависимости от варианта методики, что значительно уменьшает влияние состава мочи на результат измерения. Во-вторых, реакция протекает в сукцинатном буфере, то есть при стабильном рН. И, наконец, сам принцип метода, можно сказать, более «прозрачный». Молибдат натрия и краситель пирогаллоловый красный образуют комплекс с молекулой белка. Это приводит к тому, что молекулы красителя в свободном состоянии не поглощающие свет на длине волны 600 нм в комплексе с белком свет поглощают. Таким образом, мы как бы метим каждую молекулу белка красителем и в результате получаем, что изменение оптической плотности реакционной смеси на длине волны 600 нм четко коррелирует с концентрацией белка в моче. Причем, поскольку сродство пирогаллолового красного к разным фракциям белка практически одинаковое, метод позволяет определять общий белок мочи. Поэтому граница нормальных значений концентрации белка в моче составляет 0,1 г/л (она и указана во всех современных западных руководствах по клинико-лабораторной диагностике, в том числе и в «Клиническом руководстве по лабораторным тестам», под ред. Н. Тица). Сравнительные характеристики пирогаллолового и сульфосалицилового методов определения белка в моче представлены в Таблице 1.
В заключение, хотелось бы еще раз акцентировать внимание на том факте, что при переходе лаборатории с сульфосалицилового метода определения белка в моче на пирогаллоловый метод граница нормальных значений существенно повышается (с 0,03 г/л до 0,1г/л!). Об этом сотрудники лаборатории должны непременно поставить в известность врачей-клиницистов, т.к. при сложившейся ситуации диагноз протеинурия может быть поставлен только в том случае, когда содержание белка в моче превышает 0,1 г/л.
Список литературы.
- Альтшулер Б.Ю., Раков С.С., Ткачев Г.А. // Вопр. мед. химии. — 2001. — № 4. — C.426-438.
- Ким Ю.В., Потехин О.Е., Токар М.И., Шибанов А.Н. // Лаб. мед. — 2003. — № 6. — C.94-98.
- Клиническое руководство по лабораторным тестам, под ред. Н. Тица.- М.- Юнимед-пресс.-2003.- 942 с.
- Козлов А.В., Слепышева В.В. Методы определения белка в моче: возможности и перспективы // Сборник трудов VII ежегод. СПб нефрол. семинара. — СПб: ТНА. — 1999. — C.17-28.
- Пупкова В.И., Пикалов И.В., Хрыкина Е.Н., Харьковский А.В. // Новости «Вектор-Бест». — 2003. — № 4 (30).
- Chambers R.E., Bullock D.G., Whicher J.T. // Ann. Clin. Biochem. — 1991. — Vol. 28 (Pt 5). — P.467-473.
- Clinical Laboratury Medicine. Ed. by Kenneth D. McClatchey. — 2nd ed.-2001.- 1993p.
- Eppel G.A., Nagy S., Jenkins M.A., Tudball R.N., Daskalakis M., Balazs N.D.H., Comper W.D. // Clin. Biochem. — 2000. — Vol. 33. — P.487-494.
- Franke G., Salvati M., Sommer R.G. Composition and device for urinary protein assay and method of using the same // ПатентСША № 5326707. — 1994.
- Kaplan I.V., Levinson S.S. // Clin. Chem. — 1999. — Vol. 45. — P.417-419.
- Kashif W., Siddiqi N., Dincer H.E., Dincer A.P., Hirsch S. // Cleveland Clin. J. of Med. — 2003. — Vol. 70 (6). — P.535-547.
- Koerbin G, Taylor L, Dutton J, Marshall K, Low P, Potter JM. // Clin. Chem. — 2001. — Vol. 47. — P.2183-2184.
- Le Bricon T., Erlich D., Dussaucy M., Garnier J.P., Bousquet B. // Article in French. — Ann. Biol. Clin. (Paris). — 1998. — Vol. 56 (6). — P.719-723.
- Marshall T., Williams K.M. // Clin. Chem. — 2003. — Vol. 49 (12). — P.2111-2112.
- Pugia M., Newman D.J., Lott J.A., D’Mello L., Clark L., Profitt J.A., Cast T. // Clin. Chim. Acta. — 2002. — Vol. 326 (1-2). — P.177-183.
- Ringsrud K.M., Linne J.J. Urinalysis and body fluids: A ColorText and Atlas // Mosby. — 1995. — P.52-54.
- Shepard M.D., Penberthy L.A. // Clin. Chem. — 1987. — Vol. 33. — P.792-795.
- Williams K.M., Marshall T. // J. Biochem. Biophys. Methods. — 2001. — Vol. 47. — P.197-207.
- Williams K.M., Arthur S.J., Burrell G., Kelly F., Phillips D.W., Marshall T. // J. Biochem. Biophys. Methods. — 2003. — Vol. 57 (1). — P.45-55.
Теги:
Источник
Аналитические методы диагностики протеинурии
ЮНИТЕКА:
Анализ мочи:
14.05.2010
А.Н. Шибанов, к.ф.-м.н., Генеральный секретарь РАМЛД
Определение концентрации белка в моче является одним из наиболее часто выполняемых видов исследований в клинических лабораториях. Ежедневно в каждой лаборатории исследуется от нескольких десятков до нескольких сотен проб мочи.
Проблема разработки корректных методов определения концентрации белка в моче имеет длительную историю. Сложность проблемы состоит в том, что метод должен иметь большой диапазон определения концентрации белка: от сотых долей грамма на литр до нескольких грамм на литр. В тоже время, учитывая массовый характер данного исследования, он должен быть простым по технологии и дешевым.
Все многообразие применяемых сегодня в различных лабораториях методов определения концентрации белка в моче можно разделить на три группы:
- турбидиметрические методы,
- метод сухой химии,
- фотометрические методы.
Турбидиметрические методы
Турбидиметрические методы основаны на изменении светопропускания реакционной смесью вследствие мутности раствора белка в присутствии сульфосалициловой или других кислот. В настоящее время в российских лабораториях наиболее часто применяются три модификации метода:
- метод Брандберга-Робертса-Стольникова (азотная кислота) — полуколичественный;
- метод сульфосалициловой кислоты — количественный;
- метод трихлоруксусной кислоты — количественный.
В сыворотке крови или водном растворе с рН>7 молекулы белка имеют компактную глобулярную форму с размерами значительно меньше длины волны видимого света и практически его не рассеивают (рис. 1). Такой раствор даже при больших концентрациях белка прозрачный. В кислой среде молекулы белка денатурируют и объединяются в крупные конгломераты (реакция преципитации), размеры которых сопоставимы или больше длины волны, на которой производиться фотометрирование реакционной смеси. В результате реакции преципитации реакционная смесь становится мутной.
Визуальное наблюдение появления мутности при смешивании пробы мочи с раствором сульфосалициловой кислоты или наблюдение появления кольца мутности при наслаивании пробы мочи на азотную кислоту позволяет определять присутствие белка в моче на качественном уровне. Количественно определение концентрации белка в моче осуществляется путем фотометрирования реакционной смеси. В этом случае используется зависимость изменения пропускания света от характера мутности раствора. Чем больше образуется частиц преципитата, тем больше рассеяние света и тем меньше его пройдет через оптическую кювету фотометра.
Рис. 1. Процесс денатурации белков и реакция преципитации в кислой среде
Основными недостатками турбидиметрических методов являются:
- Большая вероятность ложноотрицательных результатов. На реакцию денатурации и последующей преципитации белков сильное влияние оказывает состав мочи: рН, концентрация солей. Для некоторых проб мочи мутность может не образовываться даже при присутствии в ней белка с концентраций более 1 г/л.
- Величина изменения светопропускания имеет нелинейную зависимость от концентрации белка в пробе мочи. Требуется выполнение многоточечной калибровки.
- Помимо белков мутность могут образовывать некоторые лекарственные вещества, выводимые с мочой, что приводит к ложноположительным результатам анализа.
- Размеры преципитатов могут зависеть от характера перемешивания пробы, что приводит к низкой воспроизводимости результатов анализов.
- При больших концентрациях белка в моче преципитаты могут выпадать в осадок крупными хлопьями.
Из-за вышеперечисленных недостатков турбидиметрический метод определения белка в моче в лабораториях развитых стран сегодня практически не применяется.
Методы «сухой химии»
В основе метода лежит эффект изменения окраски реакционной зоны тест-полоски в результате реакции красителя, присутствующего в реакционной зоне с молекулами белка мочи (рис. 2 и 3). Реакционная зона представляет собой пористую полоску, пропитанную раствором реагентов и высушенную. В состав реагентов входят вещества, обеспечивающие стабилизацию рН (буфер) и краситель тетрабромфеноловый синий. Когда реакционная зона пропитывается мочой, сухие компоненты растворяются, и происходит реакция с компонентами мочи. Если в моче отсутствует белок, то реакционная зона остается бесцветной, либо слегка желтоватой, поскольку молекулы красителя поглощают свет в синей области спектра. Если в пробе мочи, которой пропитывается реакционная зона, присутствуют молекулы белка, то молекулы красителя образуют комплексы с последними, и их спектр поглощения сдвигается в красную сторону. На рис. 3 видно, что в присутствии белка в образце отражение реакционной зоны резко уменьшается в области 620 нм. Визуально реакционная зона приобретает зеленый цвет.
Рис. 2. Принцип метода сухой химии с отражательной фотометрией
Рис. 3. Спектр отражения реакционной зоны тест-полоски Урискан в зависимости от концентрации альбумина в растворе
Оценку реакции осуществляют либо с помощью анализатора мочи (отражательного фотометра, регистрирующего изменение коэффициента отражения света на определенных длинах волн), либо визуально, соотнося изменение окраски реакционной зоны с цветовой шкалой, размещаемой обычно прямо на пенале с тест-полосками. Простота метода сделала его исключительно популярным во всем мире. Сегодня большое число фирм производят диагностические тест-полоски как для определения белка в моче, так и для ряда других показателей мочи. Одно из наиболее важных достоинств диагностических тест-полосок состоит в том, что за одну минуту можно определить до 11 показателей состава и свойств мочи.
Метод «сухой химии» является полуколичественным из-за довольно большой погрешности определения концентрации белка в моче. Поскольку реакция протекает в неразведенной моче, которой пропитывается реакционная зона тест-полоски, влияние интерферентов, содержащихся в моче, максимально. Визуальная оценка реакции привносит дополнительную ошибку из-за субъективного восприятия изменения цвета полоски. Но даже при использовании анализатора мочи — отражательного фотометра, результат измерения остается полуколичественным. При выполнении исследования с помощью тест-полосок следует также учитывать, что окраска реакционной зоны не стабильна. Это может быть обусловлено постепенным высыханием реакционной зоны и, соответственно, изменением концентрации реагентов. Поэтому регистрация реакции должна проводиться в строго заданный промежуток времени. Обычно стандартное время оценки реакции для тест-полосок примерно 60 секунд после смачивания.
Другой важной особенностью, которую следует учитывать при применении тест-полосок для определения белка в моче, является неодинаковая чувствительность метода к разным типам белков. На рис. 4 приведены зависимости коэффициента отражения тестовой зоны на белок от концентрации альбумина (кривая 1) и глобулина (кривая 2).
Рис. 4. Зависимость коэффициента отражения света реакционной зоной для разных концентраций альбумина (1) и глобулина (2).
Если в случае раствора альбумина надежно регистрируется изменение окраски тестовой зоны при концентрации 0,1 г/л, то в случае раствора глобулина окраска не изменяется даже при концентрации 1 г/л. Этот эффект обусловлен различной способностью бромфенолового синего образовывать комплексы белок-краситель с разными типами белков. Об этом обстоятельстве лаборатория должна информировать лечащих врачей, которым передаются результаты исследований проб мочи на белок.
Фотометрические методы
Фотометрический метод определения концентрации различных соединений в сыворотке хорошо известен и широко применяется в клинической биохимии. Фотометрический метод определения белка в моче относится к этому же классу. Суть метода состоит в том, что в результате взаимодействия молекулы красителя с молекулой белка в образовавшемся комплексе длинноволновая полоса поглощения молекулы красителя смещается в красную сторону на 50 — 100 нм. В результате чего появляется заметное поглощение света в той области спектра, где свободные молекулы красителя поглощают слабо (рис. 5.). При низких концентрациях белка в моче количество молекул, образовавших комплекс белок-краситель пропорционально концентрации молекул белка. К группе фотометрических методов относится метод Бредфорд, предложенный в 1976 г., в котором используется раствор красителя кумасси G-250. В 1986 г. N. Watanabe описал метод, основанный на применении комплекса красителя пирогаллоловый красный и молибдата натрия (ПГК). Спектры поглощения пирогаллолового реактива и реакции в присутствии белка показаны на рис. 5. Как видно из приведенных спектров, раствор красителя пирогаллоловый красный Юни-Тест-БМ имеет максимум поглощения в области 470 нм. При увеличении длины волны света поглощение плавно уменьшается так, что на длине волны 600 нм оно в 7 раз меньше, чем в максимуме полосы поглощения.
Если в пробе присутствуют молекулы белка, то они образуют комплекс с молекулами красителя и спектр поглощения последних сдвигается в область 600 нм, что мы и наблюдаем на рис. 5. Чем больше концентрация молекул белка, тем больше увеличение оптической плотности реакции на длине волны 600 нм. Поскольку реактив имеет заметное поглощение на длине волны 600 нм, то, очевидно, что в качестве холостой пробы следует брать реактив.
Рис. 5. Спектры поглощения реагента Юни-Тест-БМ (набор для определения белка в моче на основе красителя пирогаллоловый красный) при добавлении в него 20 мкл дистиллированной воды (1) и 20 мкл раствора альбумина 0,6 г/л (2).
Рис. 6. Зависимость оптической плотности реакции (600 нм) от соотношения содержания альбумина и глобулина в пробе при суммарной постоянной концентрации 1 г/л. Пунктирная линия — реагент Юни-Тест-БМ, сплошная линия — реагент зарубежной компании.
Спектр поглощения комплекса краситель-молибдат натрия-белок имеет резкий спад в сторону увеличения длины волны. Это позволяет использовать бихроматический метод фотометрирования: основная длина волны — 600 нм, вспомогательная — 650 — 680 нм. В этом случае устраняются все ахроматические интерференты: мутность реакции, царапины на фотометрической кювете. Бихроматический метод фотометрирования позволяет проводить измерение в круглых пробирках.
Большая эффективность поглощения света комплексами молекул красителя с белком позволяет проводить реакцию при довольно большом разведении пробы мочи реагентом и при этом иметь высокую чувствительность. Так, например, при использовании реагента «ЮНИ-ТЕСТ-БМ», при соотношении объемов мочи и реагента 100 мкл: 1 мл чувствительность метода составляет 0,01 г/л белка в моче. Большая степень разведения пробы мочи и буферные свойства реагента практически полностью устраняют влияние состава мочи на результат измерения концентрации белка.
Исследования взаимодействия красителя пирогаллоловый красный с альбумином и глобулином показали, что в отличие от бромфенолового синего ПГК имеет примерно одинаковое сродство к этим типам белков. В силу этого, результат измерения концентрации белков в моче методом ПГК слабо зависит от качественного состава белков в пробе мочи (рис. 6). Более того, в реагенте Юни-Тест-БМ удалось создать такие условия, когда эта зависимость полностью отсутствует.
Выводы и рекомендации
Материал, представленный в настоящей статье, а также в целом ряде публикаций, которые появились за последние несколько лет, убедительно доказывает, что:
- Турбидиметрические методы, основанные на реакции преципитации молекул белков в кислой среде, обладают очень плохими аналитическими характеристиками и из практики лабораторной службы должны быть исключены.
- При определении белка в моче методами «сухой химии» следует иметь в виду и информировать об этом клиницистов, что этим методом определяется преимущественно альбумин.
- Наилучшие результаты для диагностики протеинурии дает метод, основанный на применении растворов красителя пирогаллоловый красный (ПГК).
Поскольку в большинстве лабораторий определение концентрации белка в моче выполняется в больших количествах, очень важным является рациональная организация аналитического процесса. В отношении этого можно дать несколько рекомендаций, которые помогут руководителю лаборатории наилучшим образом обеспечить выполнение этого анализа.
При выборе конкретной реализации метода следует отдавать предпочтение бихроматическому методу с фотометрированием в пробирках, как это реализовано в приборе Микролаб 600. Фотометрирование проводится непосредственно в реакционных пробирках, т.о. исключается процедура переливания реакционной смеси в фотометрическую кювету, что повышает производительность работы лаборанта.
Необходимо следить за чистотой фотометрических пробирок (фотометрической кюветы). Даже небольшой налет белка на внутренней поверхности пробирки может дать ложноположительный результат. Поэтому, сразу после проведения фотометрирования реакционную смесь следует слить, а пробирку замочить в растворе моющего средства (детергента). Нельзя допускать высыхания следов реагента в фотометрических пробирках.
При дозировании проб мочи категорически запрещается пользоваться одним и тем же наконечником. Эффект переноса после дозирования мочи с высоким содержанием белка может служить причиной ложноположительных результатов для последующих проб.
Ряд фирм, выпускающих набор реагентов для определения белка в моче, в описании метода применения дают два режима, которые отличаются разным соотношением объема пробы мочи и реагента. Так для Юни-Тест-БМ это режимы со следующими соотношениями моча/реагент: 1) 100 мкл мочи на 1 мл реагента и 2) 20 мкл мочи на 1 мл реагента. Выбор режима зависит от обследуемого контингента пациентов. Если проводится скрининг на протеинурию (преобладают нулевые и низкие уровни протеинурии), то сначала все пробы мочи анализируются в режиме 100 мкл мочи на 1 мл реагента. Такой подход гарантирует, что не будут пропущены случаи относительно низкие уровни протеинурии. При выявлении положительного результата, измерение следует повторить в режиме 20 мкл мочи на 1 мл реагента.
Если в общей массе исследуемых проб мочи преобладают патологические пробы (например, отделение нефрологии), то начинать надо с режима для высоких концентраций белка (20 мкл мочи на 1 мл реагента). А для того небольшого количества проб, для которых будет получен результат близкий к нулевой концентрации, измерение повторить в режиме 100 мкл мочи на 1 мл реагента. Это позволит для каждой пробы мочи получить максимально точное значение концентрации белка и сэкономит время лаборанта.
Применение современного метода, современных приборов и рациональная организация работы лаборанта позволят вашей лаборатории выполнять определение концентрации белка в моче с высокой точность, высокой производительностью и обеспечить ваших врачей надежной диагностической информацией.
Теги:
Источник