Анализ мочи и нормы у коров
Клинический анализ мочи.
Важное диагностическое значение имеет определение рН, плотности мочи, обнаружение в ней белка, кетоновых тел, сахара, крови, пигментов и некоторых других показателей (таблица 6.6).
Таблица 6.6. Относительная плотность и рН мочи здоровых животных.
Вид животного | Плотность, г/мл | РН |
Крупный рогатый скот Овцы, козы Лошади Свиньи Кошки Собаки | 1,02 — 1,055 1,015 — 1,065 1,025 — 1,055 1,018 — 1,022 1,020 — 1,040 1,018 — 1,022 | 7,0 — 8,6 8,0 — 8,5 7,0 — 8,5 6,0 — 7,3 5,0 — :6,5 5,0 — 6,5 |
Относительная плотность мочи — это показатель, дающий представление о концентрации растворимых в ней веществ; отражает способность почек к концентрированию и разведению мочи. Плотность мочи повышается при увеличении концентрации, поступлении белка, сахара, большого количества минеральных веществ. Это наблюдается при наследственно предрасположенных заболеваниях — сахарном диабете, мочекаменной болезни.
Низкая плотность мочи обуславливается ослаблением концентрационной способности или выделительной функции почек, которые возникают, например, при несахарном диабете, нефросклерозе.
Реакция (рН) мочи зависит от количества свободных ионов водорода (Н+), выделенных при распаде органических кислот и кислых солей. Её определяют в свежеполученной моче с помощью потенциометра(точно), индикаторной бумаги или тестпластин.
Моча приобретает кислую реакцию при голодании, ацедозе рубца, изнурительных поносах, тяжёлых лихорадочных состояниях, сахарном диабете. Мочу щелочной реакции наблюдают при алкалозе рубца, хронических инфекциях в мочевых путях вследствие бактериально-аммиачного брожения (пиелонефрит, уроцистит и др.).
Обнаружение белка в моче. У здоровых животных моча практически не содержит белка. Появление белка в моче (протеинурия) может быть почечного и внепочечного происхождения. Почечная протеинурия органического происхождения возникает при поражении почек (нефрит, нефроз). Функциональная почечная протеинурия связана с увеличением проницаемости мембран почечного фильтра, при сильных раздражениях (стресс), замедлении тока крови в клубочках (охлаждение), физическом перенапряжении. Функциональную протеинурию наблюдают у новорожденных в первые дни жизни. Внепочечная протеинурия обуславливается попаданием белка в мочу из мочевыводящих и половых путей при их воспалении.
Обнаружение глюкозы в моче. Моча здоровых животных содержит минимальное количество глюкозы, которая не обнаруживается качественными пробами Глюкозурия (появление глюкозы в моче) бывает патологической (диабетическая, почечная, печеночная) и физиологической.
Диабетическая глюкозурия характерна для сахарного диабета. При нормальном функционировании почек глюкоза в моче появляется только в том случае, когда концентрации её в крови превышает пороговую. Почечная глюкозурия обуславливает нарушением резорбции глюкозы в канальцах, когда глюкозурия появляется при нормальной концентрации сахара в крови. Такое явление может быть при так называемом ренарном диабете. Хроническом нефрите.
Печеночная глюкозурия связана с понижением гликогенобразующей функции печени и наблюдается преимущественно при циррозе этого органа. Физиологическую глюкозурию наблюдают при стрессе. При поедании большого количества углеводистых кормов.
Обнаружение кетоновых (ацетоновых)тел. К кетоновым телам относятся бета-оксимаслянная, ацетоуксусная кислота и ацетон. В норме они содержатся в моче в небольшом количестве (10мг/100мл). Кетоновые тела не имеют пороговой почечной концентрации, поэтому их содержание увеличивается в моче при накоплении в крови. Это отмечается при кетозе, тяжелой форме сахарного диабета, эндометрите, хирургической инфекции, стрессах.
В необходимых случаях в моче проводят обнаружение крови, гемоглобина, миоглобина, билирубина, индикана, уробилиновых тел и других веществ, исследуют осадки мочи.
Дополнительные материалы:
Источник
ИССЛЕДОВАНИЕ МОЧИ — ИССЛЕДОВАНИЕ ФЕКАЛИЙ
| ИССЛЕДОВАНИЕ МОЧИ — ИССЛЕДОВАНИЕ ФЕКАЛИЙ |
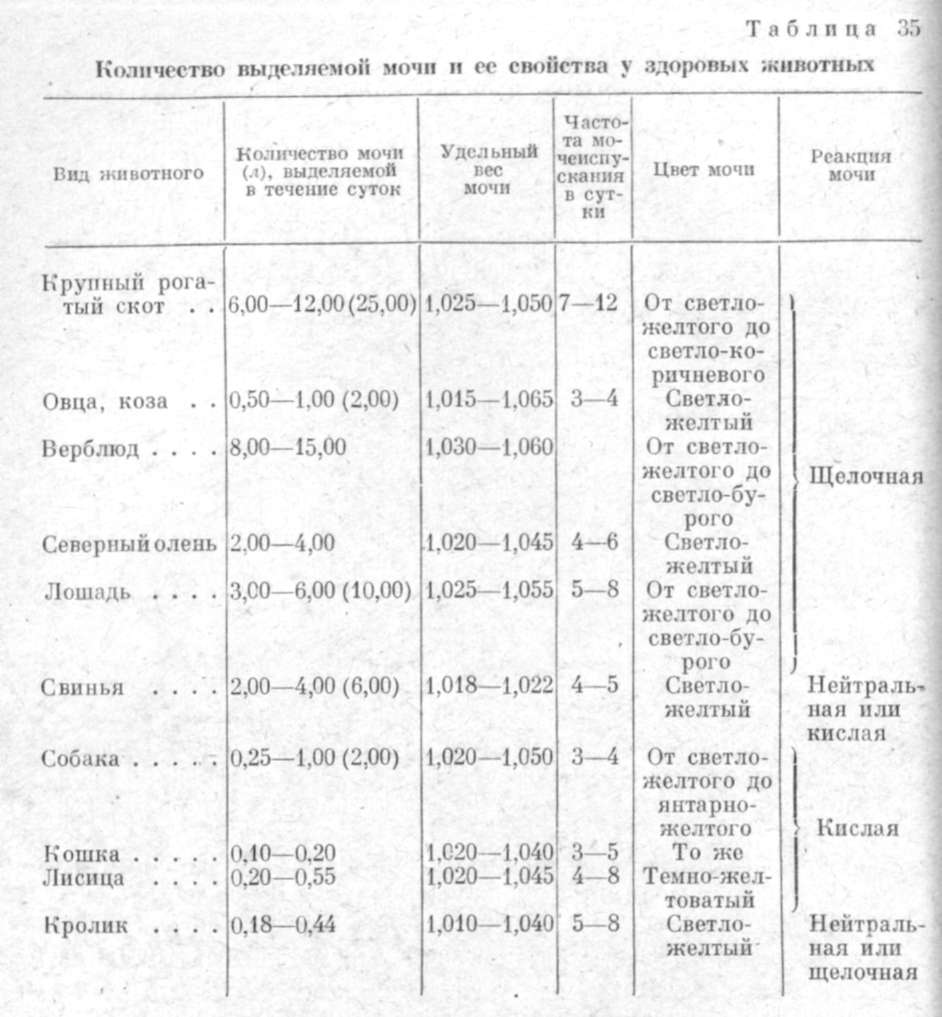
ИССЛЕДОВАНИЕ МОЧИ Физические свойства мочи. Исследование физических свойств мочи включает определение величины суточного диуреза, удельного веса, запаха, цвета и консистенции мочи. Физические свойства мочи, ее реакция и частота мочеиспусканий у здоровых животных приведены в табл. 35. Определение химических свойств мочи. При исследовании химических свойств мочи определяют содержание в ней белка, глюкозы, лактозы и мальтозы, кровяных пигментов, ацетона и др. Исследование на белок. В моче здоровых животных, как правило, белок обычными методами не обнаруживается. Альбуминурия — выделение белка с мочой — может быть следующей. 1. Физиологической — при скармливании большого количества концентрированных кормов, после сильного мышечного напряжения и у новорожденных животных. 2. Патологической: 1) ложной — когда белок попадает в мочу при заболеваниях мочевыводящих путей и из половых органов; 2) истинной — при заболеваниях почек (нефриты, нефрозы), при многих инфекционных заболеваниях (мыт, инфекционная анемия, чума собак, злокачественная катаральная горячка, рожа свиней и др.), гемоспоридиозах, отравлениях различными ядами. При исследовании на белок моча должна быть свежей и прозрачной, мутную мочу фильтруют. Качественное определение белка. Наличие белка в моче можно определять пробой кипячением и пробой с сульфосалициловой кислотой.
1. Проба кипячением. В пробирку наливают 5-10 мл мочи и прибавляют 5-10 капель 10%-ного раствора уксусной кислоты, смешивают и подогревают верхний слой мочи до кипения. При наличии белка в моче появляется опалесценция (муть) или хлопьевидный осадок. При отрицательном результате исследования к еще горячей моче приливают равный объем насыщенного раствора поваренной соли. Быстрое помутнение всей жидкости свидетельствует о наличии белка. 2. Проба с сульфосалициловой кислотой (по Рош и Вильяму). К 3-5 мл мочи прибавляют по каплям 20%-ный раствор сульфосалициловой кислоты (хранят в темном флаконе в темноте). При наличии белка появляется опалесценция или белый хлопьевидный осадок. Помутнение, вызванное наличием альбумоз, при нагревании мочи исчезает, а при охлаждении появляется вновь. Количественное определение белка (по Эсбаху). В альбуминометр (градуированная пробирка с коническим дном) наливают до метки «Р» реактив (пикриновая кислота — 1 г, лимонная кислота — 2 г, дистиллированная вода — 100 мл), до метки «М» добавляют подкисленную прозрачную мочу. Сосуд плотно закрывают резиновой пробкой и смешивают осторожно обо жидкости. Заряженный альбуминометр оставляют при комнатной температуре на 24 часа, после чего определяют количество белка по шкале. Найденное число показывает содержание белка в г°/00. Альбуминометр Эсбаха снабжен делениями от 0,1 до 12,0 г°/оп. Исследование на глюкозу. Моча здоровых животных обычно не содержит Сахаров, в том числе и глюкозы. Глюкозурия — выделение глюкозы с мочой — может быть следующей. 1. Физиологической — при скармливании животным кормов, содержащих много углеводов (алиментарная глюкозурия). 2. Патологической: 1) токсической — вследствие отравления ядами (скипидар, окись углерода, сулема и др.); 2) симптоматической — как один из признаков заболевания животных (сахарный диабет, бешенство травоядных, нервная форма чумы собак, болезнь Ауески, болезни печени, повреждения черепа и др.). Качественное определение глюкозы. Определяют глюкозу в моче пробой с медным купоросом (по Бенедикту). В пробирку берут 5 мл реактива (медный купорос — 17,3 г, лимоннокислый натрий — 173 г, углекислый натрий — 100 г, дистиллированная вода — до 1 л, прибавляют 8-10 капель (0,4-0,5 мл) мочи. Пробирку нагревают 2 минуты на пламени или 5 минут в кипящей водяной бане, после чего пробирку охлаждают 5-7 минут. При наличии в моче сахара жидкость приобретает зеленую, желтую или красную окраску с осадком на дне пробирки. При зеленой окраске жидкости, но без наличия осадка на дне пробирки реакция считается отрицательной. Положительную реакцию отмечают при содержании в моче глюкозы выше 0,05 г%. При 0,05-0,50 г% глюкозы цвет жидкости зеленый, 0,5-1,0 г% — желто-зеленый, при 1 г% — желтый, выше 2 г% — красный. Количественное определение глюкозы. Количество глюкозы в моче определяют бродильной пробой. В прооирку наливают 20 мл мочи (освобожденной от белка кипячением и фильтрованием) и прибавляют кусочек дрожжей величиной с горошину, тщательно растирают стеклянной палочкой до образования тонкой эмульсии. Полученной мутной жидкостью заряжают сахарометр Эйнгорна с таким расчетом, чтобы в верхнем слепом конце прибора (со шкалой) не было воздуха. Заряженный сахарометр помещают в термостат на 24 часа при температуре 61 . В результате брожения глюкозы в верхнем (слепом) конце приоора скапливается над мочой двуокись углерода. По шкале делении, нанесенных на этом конце сахарометра, определяют личество сахара (левая шкала показывает процент сахара,правая — объем двуокиси углерода). Молочный сахар в отличие от глюкозы не дает брожения. Исследование на мальтозу и лактозу (по Вёлку). К 10 мл мочи прибавляют 5 мл концентрированного раствора аммиака и 10 капель 20%-ного раствора едкого калия. Нагревают в водяной бане при 60° 30 минут. При наличии мальтозы через несколько минут появляется красный цвет. Коричневая окраска указывает на присутствие в моче, лактозы. Л а к т о з у р и я — появление в моче молочного сахара — наблюдается при маститах, родильном парезе, закупорке сосков вымени, а также при стельности коров (физиологическая лактозурия). Исследование на пигменты крови. Пигменты крови в моче могут быть обнаружены: 1) при гематурии, возникшей вследствие крово- течения в мочевые органы (травма почек, распад новообразований, геморрагический инфаркт почек, воспаление их, почечные колики, травмы и воспаление мочевыводящих путей); 2) при гемогло- бинурии, явившейся результатом повышенного распада зритроцитов (при отравлениях, гемоспоридиозах, миоглобинурии, плевропневмонии, гангрене легких). Обнаруживают кровяные пигменты в моче бензидиновой пробой (по Адлеру). В пробирку вносят на кончике ножа бензидин, растворяют его в 1 мл концентрированной уксусной кислоты, прибавляют 1 мл 3%-ной перекиси водорода и 3 капли подкисленной уксусной кислотой мочи. При наличии крови в моче жидкость окрашивается от зеленого до синего цвета. Определение индикана. У здоровых животных в моче постоянно содержится индикан. Индиканурия — увеличение выделения индикана с мочой — встречается при заболеваниях, связанных с усиленным распадом белка в тканях (гнойный плеврит, гангрена легких и др.) или с интенсивным гниением белковых веществ в кишечнике (кишечная непроходимость, острый или хронический катар тонких кишок с резким ослаблением перистальтики и др.). Наличие индикана в моче определяют пробой с хлорным железом (по Обермейеру). В пробирку берут 5 мл мочи, подкисленной несколькими каплями соляной кислоты, и прибавляют 0,5-1,0 мл 20%-ного раствора уксуснокислого свинца. Взбалтывают и фильтруют через бумажный фильтр. К фильтрату добавляют равный объем реактива Обермейера (хлорное железо — 0,2 г, концентрированная соляная кислота — 100 мл) и 2унл хлороформа. Закрытую резиновой пробкой пробирку несколько раз переворачивают, хлороформ опускается на дно и при наличии индикана окрашивается в синий или фиолетовый цвет. Определение кетоновых (ацетоновых) тел. Кетоновые, или ацетоновые, тела (ацетон, ацетоуксусная и бета-оксимасляная кислота) являются нормальной составной частью мочи, но обычными качественными пробами они не выявляются. Кетонурия (ацетонурия) — выделение с мочой большого количества указанных тел — сопровождает такие заболевания как ацетонемия коров, алиментарная кетонурия суягных овец (нервичные кетозы), иногда родильный парез, сахарный диабет, атонии преджелудков и тимпании, кормовые отравления, травматический ретикулит, катары и воспаление сычуга, ряд заболеваний половых органов, паратиф телят (вторичные кетозы). Для обнаружения в моче кетоновых тел применяют пробу с нитропрусспдом натрия. На кусочек фильтровальной бумаги насыпают немного реактива (сернокислый аммоний — 20 г, углекислый натрий — 20 г, нитропруссид натрия — 1 г, на реактив наносят 1 — 2 капли мочи. При наличии кетоновых тел сероватый порошок приобретает цвет от розового до темно-фиолетового. Моча, не имеющая повышенного содержания кетоновых тел, цвет порошка не изменяет. Определение уробилина. В норме уробилин содержится в моче в незначительном количестве. Уробилинурия — увеличенное содержание уробилина в моче — встречается при относительной или абсолютной неспособности печени задерживать уробилиноген, что наблюдается при гепатитах, гемоспоридиозах, отравлениях четыреххлористым углеродом и сероуглеродом, абсцессе легких, пневмонии, кровопятнистой болезни, чуме собак. Уробилин определяют в моче пробой с кислотой и эфиром (по Флоренсу в модификации Н. Н. Комарицина). В пробирку к 5 мл мочи медленно прибавляют 5-8 капель крепкой серной кислоты, перемешивают и вливают 2 мл этилового эфира. Закрывают пробкой и переворачивают пробирку в течение 3-5 минут. После отстаивания (примерно 5 минут) отсасывают около 1 мл верхнего слоя эфира и смешивают с 1 мл концентрированной соляной кислоты в другой пробирке. При наличии уробилина в моче смесь постепенно изменяет свою окраску и к исходу 10-й минуты может приобрести цвет от розового до вишнево-красного. Микроскопическое исследование осадка мочи. Осадок получав ют отстаиванием, фильтрованием или центрифугированием мочи. Лучше всего подвергнуть мочу центрифугированию в течение 10 ми-j нут. Жидкую часть мочи сливают, а затем в пипетку набирают небольшое количество осадка, который переносят на предметное стекло и распределяют по нему тонким слоем. Вначале препарат! рассматривают под микроскопом при малом, а затем при среднем увеличении. Неорганизованные осадки: 1) щелочной мочи — углекислый кальций, триппельфосфат, фосфорнокислый кальций, гиппуровая кислота, мочекислый аммоний; 2) кислой мочи — щавелевокислый кальций, сернокислая известь, мочевая кислота,; ураты. Организованные осадки: клеточные элементы — лейкоциты и эритроциты, клетки эпителия (почечного, почечной лоханки, мочевыводящих путей); микроорганизмы, спермин; цилиндры — мочевые, эпителиальные, зернистые, восковые, гиалиновые. ИССЛЕДОВАНИЕ ФЕКАЛИЙ Определение физических свойств фекалий. При исследовании физическихсвойств фекалий обращают внимание на их цвет, запах, консистенцию, а также на наличие в них посторонних примесей — инородных тел, пузырьков газа, слизи, крови, гноя и т. п. Химическое исследование фекалий. Основной задачей химического,исследования фекалий является определение в них органических кислот, аммиака, крови, стеркобилина и билирубина. Определение органических кислот (по Гуаффону и Ру). Из хорошо размешанного кала отвешивают в фарфоровую ступку пробу в 10 г. Затем наливают в цилиндри100 мл воды и постепенно приливают из него 80-90 мл в ступку с калом, тщательно растирая его; сюда же прибавляют 2 мл 30%-ного .раствора иолуторахлористого железа к,20-30 капель 1 %-ного спиртового раствора фенолфталеина. Отвешивают 2 г гидрата окиси кальция (гашеной извести), смешивают с оставшейся в цилиндре водой и сливают в ту же ступку. Все вместе тщательно размешивают, смесь должна иметь красный цвет, в противном случае прибавляют еще гидрат окиси кальция. Через 10 минут смесь фильтруют через бумажный фильтр. В химический стаканчик отмеривают 25 мл прозрачного красного фильтрата и нейтрализуют его 0,1 и. раствором соляной кислоты до появления розового цвета. В случае обесцвечивания от неосторожного прибавления избытка соляной кислоты можно восстановить слабо-розовое окрашивание прибавлением по каплям 0,1 н. раствора едкого натра. Количество щелочи, прибавленной для нейтрализации соляной кислоты, не учитывают при расчете. К нейтральному фильтрату прибавляют 15 капель 0,5%-ного спиртового раствора диметиламидоазобензола и титруют 0,1 н. раствором соляной кислоты до изменения желтого цвета в розовато-оранжевый. Расчет: количество миллилитров 0,1 н. раствора соляной кислоты, пошедшее на титрование, соответствует содержанию органических кислот в 25 мл фильтрата; его умножают на 4, чтобы привести к 100 мл фильтрата, что будет соответствовать содержанию органических кислот в 10 г кала. В норме, т. е. при равновесии активности бродильной и гнилостной микрофлоры, содержание органических кислот в кале выражается следующей величиной: у лошади -12 мл, у телят однодневного возраста — 2,7 мл (от 1,2 до 6,4), в возрасте 2-15 дней — 7,8 мл (от 2,4 до 22,0), в возрасте 15-30 дней — 8,1 мл (от 2,0 до 15,6) и в возрасте старше 30 дней — 9,9 мл (от 4,0 до 19,0) и у собак — 7,9-18,0 мл. При усиленном брожении Количество органических кислот увеличивается, а от усиления гнилостных процессов, подавляющих бродильную микрофлору, — уменьшается. Определение аммиака (по Гуаффону и Ру). Для исследования на аммиак, кроме реактивов, применяемых для определения органических кислот (см. выше), нужен продажный формалин. Его разводят пополам дистиллированной водой и непосредственно перед употреблением нейтрализуют 0,1 н. раствором едкого натра в присутствии индикатора фенолфталеина. Для определения аммиака берут 25 мл фильтрата, оставшегося от определения органических кислот, точно так же нейтрализуют, как в упомянутом анализе, до появления бледно-розового цвета. Затем прибавляют 5 мл нейтрализованного формалина, несколько капель фенолфталеина и титруют 0,1 н. раствором едкого натра до появления неисчезающей розовой окраски. Количество аммиака в кале выражают числом миллилитров раствора щелочи, потребным для нейтрализации 100 мл фильтрата (т. е. 10 г кала), для чего потраченное при титровании количество щелочи умножают на 4. В норме содержание аммиака соответствует у лошади 2-3 мл, у телят однодневного возраста — 2,4 мл (от 1,0 до 3,6), в возрасте 2-15 дней — 6,4 мл (от 1,6 до 12,0), в возрасте 15-30 дней — 5,6 мл (от 2,8 до 10,8) и в возрасте старше 30 дней — 2,3 мл (от 0,6 до 6,0) и у собак — 3,2-8 мл. Увеличение содержания аммиака свидетельствует об усилении процессов гнилостного распада белка в кишечнике; содержание аммиака ниже нормы указывает на уменьшение гниения. Определение крови (по Адлер — Шлезингер — Хольсту). В чистую сухую пробирку опускают небольшое количество бензидина, взятого на кончике ножа, и добавляют 2,5-3,0 мл крепкой уксусной кислоты. К полученному прозрачному, буровато-серого цвета раствору приливают 3 мл 3%-ной перекиси водорода. Небольшой кусочек кала, тщательно размешивая, разводят в 5-6 мл воды и 5 — 6 капель этой смеси вливают в пробирку с реактивом. При на¬ личии в кале крови жидкость в пробирке окрашивается в зеленый, гине-зеленый или синий цвет. Определение стеркобилина и билирубина. Кусочек кала растают в фарфоровой ступке с небольшим количеством концентрированного раствора сулемы (12,5 г сулемы растворяют при нагревании в 250 мл дистиллированной воды, фильтруют) и оставляют в открытой чашке Петри при комнатной температуре на 10-20 часов Кал, содержащий стеркобилин, окрашивается в кирпичнокрасный цвет, а частицы кала, содержащие неизмененный билирубин, окрашиваются при этом в зеленый цвет. Похожий материал по теме:
|
Источник